题目内容
一定量的氢气在氯气中燃烧,所得混合物用100ml 3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)所得溶液中Cl-的物质的量为 mol。
(2)参加反应的氢气在标准状况下的体积是 L。(写出计算过程,下同)
(3)所用氯气和参加反应的氢气的物质的量之比为 。
(1)0.25 (2)2.24 (3)3:2
解析试题分析:(1)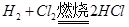
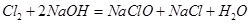
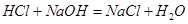
所以0.1L*3.00mol/L=0.3mol的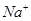 一部分与
一部分与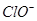 结合为NaClO,一部分与Cl-结合为
结合为NaClO,一部分与Cl-结合为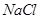 ,因为NaClO的物质的量为0.05 mol,故0.3-0.05=0.25mol
,因为NaClO的物质的量为0.05 mol,故0.3-0.05=0.25mol
(2)因为NaClO的物质的量为0.05 mol,根据化学方程式可得有0.05mol的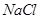 ,因为一共有0.25mol的
,因为一共有0.25mol的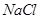 ,所以有0.2mol的
,所以有0.2mol的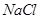 是由
是由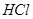 和
和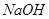 生成的。根据化学方程式,可知有0.1mol的
生成的。根据化学方程式,可知有0.1mol的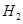 和
和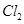 发生反应,0.1mol的
发生反应,0.1mol的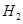 在标准状况下的体积是2.24L。
在标准状况下的体积是2.24L。
(3)因为NaClO的物质的量为0.05 mol,所以参与反应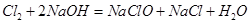 的
的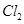 为0.05mol,根据上题可知有0.1mol的
为0.05mol,根据上题可知有0.1mol的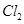 参与反应
参与反应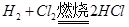 ,所以一共有0.15mol的
,所以一共有0.15mol的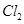 ,0.1mol的
,0.1mol的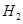 ,所以所用氯气和参加反应的氢气的物质的量之比为0.15:0.1=3:2
,所以所用氯气和参加反应的氢气的物质的量之比为0.15:0.1=3:2
考点:考查物质的量。

 天天练口算系列答案
天天练口算系列答案CO是常见的化学物质,有关其性质和应用的研究如下。
(1)有同学认为CO可以被酸性高锰酸钾溶液氧化为CO2,请你设计实验验证该同学的猜想是否正确。请在下列流程图方框内填上所需药品的名称或化学式,从而补齐你的设计,方框不够可以补,也可以不填满。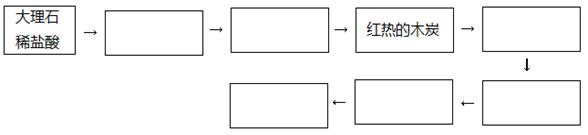
(2)CO和铁粉在一定条件下可以合成五羰基合铁[Fe(CO)5],该物质可用作无铅汽油的防爆剂,是一种浅黄色液体,熔点—20.5℃,沸点103℃,易溶于苯等有机溶剂,不溶于水,密度1.46~1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃。五羰基合铁的制备原理如下:
Fe(s)+5CO(g) Fe(CO)5(g)
Fe(CO)5(g)
①下列说法正确的是 。
| A.利用上述反应原理可制备高纯铁 |
| B.制备Fe(CO)5应在隔绝空气的条件下进行 |
C.反应Fe(s)+5CO(g) Fe(CO)5(g)的平衡常数表达式为 Fe(CO)5(g)的平衡常数表达式为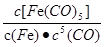 |
| D.Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存 |
③今将一定量的Fe(CO)5的苯溶液,用紫外线照射片刻。取照射后的溶液完全燃烧,得到30.58gCO2、
5.4gH2O及1.6g红棕色粉末。红棕色粉末的化学式为 ,照射后的溶液中Fe(CO)5和Fe2 (CO)9的物质的量之比为 .

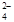 + 2Fe2+ + 4H+
+ 2Fe2+ + 4H+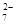 + 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O