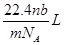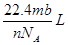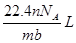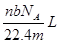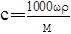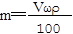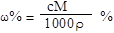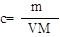题目内容
工业上常用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路板,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+。取上述反应后溶液20mL进行分析,测得其中c(Fe3+)为1mol/L,向其中加入足量的AgNO3溶液,生成沉淀 17.22g。则上述反应后20mL溶液中c(Cu2+)为
| A.0.5 mol/L | B.1mol/L | C.1.5 mol/L | D.2mol/L |
A
解析试题分析:根据题意得:因为有17.22g的AgCl,即0.12mol的AgCl,因为AgNO3溶液足量,所以原来有0.04mol的FeCl3,没有参与2Fe3++Cu=2Fe2++Cu2+反应的Fe3+为0.02*1mol,即0.02mol,则有0.04-0.02=0.02mol的Fe3+参与反应,根据离子方程式可知有Cu2+0.01mol,所以c(Cu2+)为0.01/0.02=0.5mol/L。
考点:考查离子反应。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
38.4mg Cu跟适量的浓HNO3反应,Cu全部作用后,在标准状况下收集到22.4mL(不考虑NO2部分聚合成N2O4),则消耗HNO3的物质的量( )
| A.1.0×10—3mol | B.1.6×10-3mol | C.2.2×10—3mol | D.2.4×10—3mol |
NA表示阿伏加德罗常数,下列说法正确的是:
| A.2 mol·L-1的Na2SO4溶液中含有4NA个Na+ |
| B.18克水所含的电子数为10NA |
| C.在标准状况下,11.2L氖气中含有NA个氖原子 |
| D.NA个水分子的相对分子质量之和等于水的摩尔质量 |
下列说法正确的是
| A.同温同压下甲烷(CH4)和氧气的密度之比为2∶1 |
| B.1 g甲烷和1 g氧气的原子数之比为5∶1 |
| C.等物质的量的甲烷和氧气的质量之比为2∶1 |
| D.在标准状况下等质量的甲烷和氧气的体积之比为1∶2 |
铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为0.5mg。那么一个铅笔字含有的碳原子数约为( )
| A.2.5×1019个 | B.2.5×1022个 | C.1.25×1019个 | D.1.25×1022个 |
下列说法正确的是( )
| A.0.5mol SO2和11.2LCO2所含的分子数目一定相等 |
| B.25℃和100℃时,水的pH相等 |
| C.中和等体积、等物质的量浓度的NaOH和氨水所消耗的n(H2SO4)相等 |
D.2SO2(g)+O2(g) 2SO3(g) 和4SO2(g)+2O2(g) 2SO3(g) 和4SO2(g)+2O2(g) 4SO3(g)的△H相等 4SO3(g)的△H相等 |