题目内容
(1)相同质量的SO2、SO3的物质的量之比为____________;氧原子的个数之比为_ _______。
(2)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是____________;ACl2的化学式是__________。
(1)5∶4 5∶6 (2)95 g·mol-1 24 MgCl2
解析试题分析:(1)根据 n=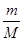 可知,相同质量的SO2、SO3的物质的量之比=
可知,相同质量的SO2、SO3的物质的量之比=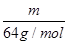 :
: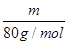 =5∶4;氧原子的个数之比=5×2∶4×3=5∶6。
=5∶4;氧原子的个数之比=5×2∶4×3=5∶6。
(2)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的物质的量=0.4mol÷2=0.2mol,因此根据n=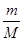 可知,该化合物的摩尔质量M=19.2g÷0.2mol=95 g/mol;氯元素的相对原子质量35.5,所以A的相对原子质量=95-35.5×2=24,因此A是Mg,则该化合物的化学式是MgCl2。
可知,该化合物的摩尔质量M=19.2g÷0.2mol=95 g/mol;氯元素的相对原子质量35.5,所以A的相对原子质量=95-35.5×2=24,因此A是Mg,则该化合物的化学式是MgCl2。
考点:考查物质的量的有关计算、化学式确定

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案用NA表示阿伏加德罗常数,下列说法错误的是:
| A.1mol C2H6分子中共含7NA个共价键 |
| B.25℃时,1mL纯水中含水10-10NA个OH-离子 |
| C.当NO2溶于水产生1molNO时,反应转移的电子数为2NA。 |
| D.标准状况下,22.4L三氧化硫所含的氧原子数等于3NA |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B.25℃,1.01×105 Pa,32 g O2和O3的混合气体所含原子数为2.5NA |
| C.标准状况下,11.2 L H2O含有的原子数为1.5NA |
| D.常温常压下,44 g CO2含有的原子数为3NA |
工业上常用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路板,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+。取上述反应后溶液20mL进行分析,测得其中c(Fe3+)为1mol/L,向其中加入足量的AgNO3溶液,生成沉淀 17.22g。则上述反应后20mL溶液中c(Cu2+)为
| A.0.5 mol/L | B.1mol/L | C.1.5 mol/L | D.2mol/L |
在相同温度和压强下,4个容器中分别装有4种气体,已知各容器中的气体和容器的容积分别是a.CO2,100 mL;b.O2,200 mL;c.N2,400 mL;d.CH4,600 mL,则4个容器中气体的质量由大到小的顺序是 ( )
| A.a>b>c>d | B.b>a>d>c | C.c>d>b>a | D.d>c>a>b |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
| A.甲的分子数比乙的分子数多 | B.甲的物质的量比乙的物质的量少 |
| C.甲的摩尔体积比乙的摩尔体积小 | D.甲的相对分子质量比乙的相对分子质量小 |
在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿佛加德罗常数可近似表示为( )
| A.22.4(m+n) | B.22.4×6.02×1023(m+n) |
| C.22.4(m+n)/(6.02×1023) | D.m+n |