题目内容
【题目】下列离子方程式书写正确的是( )
A. 碳酸氢根离子的电离:HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
B. 硫离子的水S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C. 钢铁吸氧腐蚀时的正极反应:2H2O+O2+4e-=4OH-
D. 用惰性电极电解MgCl2溶液:2Cl-+2H2O=H2↑+Cl2↑+2OH-
【答案】C
【解析】A.碳酸氢根离子是多元弱酸的酸根离子,电离生成氢离子、碳酸根离子,方程式为:HCO3-![]() CO32-+OH-,HCO3-+H2O
CO32-+OH-,HCO3-+H2O ![]() H2CO3+OH-是碳酸氢根离子是水解方程式,故A错误;B.硫离子是二元弱酸氢硫酸的酸根离子,水解应分步进行,S2-+H2O
H2CO3+OH-是碳酸氢根离子是水解方程式,故A错误;B.硫离子是二元弱酸氢硫酸的酸根离子,水解应分步进行,S2-+H2O![]() HS-+OH-以第一步为主,进而发生HS-++H2O
HS-+OH-以第一步为主,进而发生HS-++H2O![]() H2S+OH-,故B错误;C.钢铁中含有碳、铁,根据原电池工作原理,碳作正极,铁作负极;负极失电子变成离子进入溶液,正极上得电子发生还原反应,钢铁发生吸氧腐蚀时,正极上氧气得电子和水反应生成氢氧根离子,所以正极反应:2H2O+O2+4e-=4OH-,故C正确;D.用惰性电极电解MgCl2溶液因电解时在阴极附近产生了大量OH-,OH-能与Mg2+反应Mg2++2Cl-+2H2O
H2S+OH-,故B错误;C.钢铁中含有碳、铁,根据原电池工作原理,碳作正极,铁作负极;负极失电子变成离子进入溶液,正极上得电子发生还原反应,钢铁发生吸氧腐蚀时,正极上氧气得电子和水反应生成氢氧根离子,所以正极反应:2H2O+O2+4e-=4OH-,故C正确;D.用惰性电极电解MgCl2溶液因电解时在阴极附近产生了大量OH-,OH-能与Mg2+反应Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑,故D错误;故选C。
Mg(OH)2↓+H2↑+Cl2↑,故D错误;故选C。

 阅读快车系列答案
阅读快车系列答案【题目】分别按下图A、B、C所示装置进行实验,图中三个烧杯里的溶液为同浓度的稀硫酸。请回答下列问题:
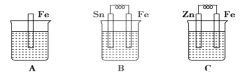
(1)以下叙述中,正确的是__________
A.B中铁片是负极,C中铁片是正极
B.三个烧杯中铁片表面均有气泡产生
C.A、B两烧杯中溶液的pH均增大
D.产生气泡的速率A中比B中慢
E.B溶液中SO42-向Sn电极移动
(2)装置B变化过程中能量转化的形式主要是:____________。
(3)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?__________(填“是”或“否”),理由是__________.
(4)A、B、C三个烧杯中铁的腐蚀速率________>_______>______
(5)对于反应2A2+B2=2A2B,已知A2、B2、A2B的键能如下表:
化学键 | A-A | B=B | A-B |
键能KJ/mol | 236 | 406 | 163 |
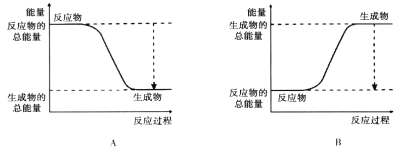
右图能正确表示该反应过程中能量变化的选项是_______。
【题目】元素A的各级电离能数据如下:则元素A的常见价态是( )
I1 | I2 | I3 | I4 | I5 | I6 | |
I/kJ·mol-1 | 578 | 1817 | 2745 | 11578 | 14831 | 18378 |
A. +1 B. +2 C. +3 D .+6