题目内容
【题目】实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸。
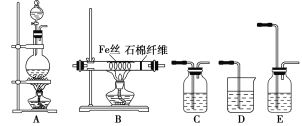
(1)按气体流向由左到右排列,各装置的连接顺序为(填写A~E序号):__接__接___接__接__。
(2)装置连接好后,应该首先进行的实验操作是____________________________________________。
(3)A装置烧瓶中反应的离子方程式是_________________________________________。
(4)E中盛装的试剂是________,其作用是_________________________________________。
(5)停止反应后,还有铁丝剩余。为检验FeCl3的生成,并最终得到FeCl3溶液,甲同学设计以下实验步骤:
a.待B装置玻璃管冷却后,将管中物质用水溶解,________(填操作方法)除去不溶物;
b.取少量滤液,滴加________溶液,溶液呈现红色,以此检验Fe3+;
c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-。
(6)乙同学认为甲的实验设计不能最终得到FeCl3溶液,其理由是(写出相应的离子反应方程式)__________________________________________________________________。
你认为还选择下列哪些试剂才能制得较为纯净的FeCl3溶液________。
A.KMnO4(H+) B.Fe C.H2O2 D.Cl2 E.盐酸
【答案】AECBD检查装置的气密性MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O饱和食盐水除去氯化氢过滤KSCN溶液2Fe3++Fe===3Fe2+CD
Mn2++Cl2↑+2H2O饱和食盐水除去氯化氢过滤KSCN溶液2Fe3++Fe===3Fe2+CD
【解析】
(1)要制备FeCl3,需先制备氯气,然后净化和干燥,再制备FeCl3,最后进行尾气吸收,所以按气体流向由左到右排列,各装置的连接顺序为AECBD。
(2)装置连接好后,应该首先进行的实验操作是检查装置的气密性。
(3)A装置是实验室制氯气,烧瓶中反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(4)制备的氯气中有HCl和水蒸气,先除HCl,E中盛装的试剂是饱和食盐水,其作用是除去HCl。
(5)除去不溶物用过滤的方法;Fe3+遇SCN-显红色,检验Fe3+用KSCN溶液。
(6)停止反应后,还有铁丝剩余,说明会发生反应2Fe3++Fe===3Fe2+,导致溶液中最终不能得到FeCl3溶液;要想制得较为纯净的FeCl3溶液,需要加入具有氧化性的物质将Fe2+氧化成Fe3+,且不能引入杂质,H2O2、Cl2均能将Fe2+氧化,且不引入杂质。

 名校课堂系列答案
名校课堂系列答案【题目】某同学用某种粗盐进行提纯实验,步骤如下图所示。
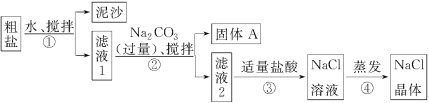
请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是__________________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ________ | 猜想Ⅰ 成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | ________ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,________ | ________ | 猜想Ⅲ 成立 |