题目内容
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成.回答下列问题:
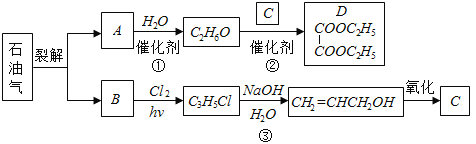
(1)B和A为同系物,B的结构简式为 .
(2)反应①的化学方程式为 ,其反应类型为 .
(3)反应③的反应类型为 .
(4)C的结构简式为 .
(5)反应②的化学方程式为 .
【答案】(1)B和A为同系物,B的结构简式为 CH2=CHCH3 .(2分)
(2)反应①的化学方程式为 CH2=CH2+H2O![]() CH3CH2OH ,(3分)其反应类型为 加成反应 .(1分)
CH3CH2OH ,(3分)其反应类型为 加成反应 .(1分)
(3)反应③的反应类型为 水解反应或取代反应 .(1分)
(4)C的结构简式为 HOOC﹣COOH .(2分)
(5)反应②的化学方程式为 HOOC﹣COOH+2CH3CH2OH![]() CH3CH2OOCCOOCH2CH3+2H2O .
CH3CH2OOCCOOCH2CH3+2H2O .
【解析】
试题分析:C2H6O与C反应生成D,由D可知C是HOOC-COOH,C2H6O是C2H5OH,则A是CH2=CH2,与水发生加成反应生成C2H5OH;C3H5Cl发生水解反应生成CH2=CH-CH2OH,C3H5Cl的结构为CH2=CH-CH2Cl;B为CH2=CH-CH3;CH2=CH-CHO氧化得HOOC-COOH;由以上分析可知(1)B的结构简式为CH2=CHCH3.
(2)反应①是乙烯与水生成乙醇,化学方程式为CH2=CH2+H2O![]() CH3CH2OH,其反应类型为加成反应.
CH3CH2OH,其反应类型为加成反应.
(3)反应③是CH2=CH-CH2Cl水解生成CH2=CH-CH2OH,反应类型为取代反应.
(4)C的结构简式为HOOC﹣COOH.
(5)反应②是乙二酸与乙醇生成乙二酸二乙酯,化学方程式为HOOC﹣COOH+2CH3CH2OH![]() CH3CH2OOCCOOCH2CH3+2H2O。
CH3CH2OOCCOOCH2CH3+2H2O。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】回归、改进、拓展教材实验,是高考化学实验考查的常见形式。
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究。基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理。
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式__________________________________。
(2)①该催化剂中铁元素的化合价为 。
②下图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是 。

II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
![]()
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+ 对该反应有催化作用
假设3:K+ 对该反应有催化作用
【设计、完成实验】
(3)称取 g草酸晶体(H2C2O4·2H2O),配制500 mL 0.10 mol/L H2C2O4溶液。在上述过程中必须用到的2种定量仪器是托盘天平和
(4)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
仔细阅读分析表中数据,回答问题:
x = mL,假设__________成立(填“1” 、“2”或“3”)