题目内容
【题目】(1)含氢原子为0.2×6.02×1024个的NH4HCO3,其质量是___,其中含氧原子的物质的量为___。3.6克水中含有质子数为___(阿伏伽德罗常数为NA)。
(2)现实验室要用12mol·L-1氢氧化钠溶液来配制浓度为0.6mol·L-1的稀氢氧化钠溶液100mL,则需要这种浓碱的体积是___mL。需要用托盘天平称量___克氢氧化钠才能配制成0.5mol·L-1的氢氧化钠溶液100mL。
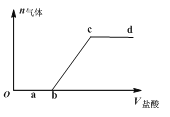
(3)将标况下aLHCl气体溶于配制成1L盐酸溶液,所得溶液密度为dg/cm3,则所得溶液物质的量浓度为___mol/L,该溶液中溶质的质量分数为___。
(4)在标准状况下,某气体A的密度是1.25g·L-1,则它的摩尔质量是___,同温同压下该气体相对于氢气的密度是___;在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,此混合气体的平均相对分子质量是___,混合物中CO和CO2物质的量之比是___。
【答案】31.6克 1.2mol 2NA 5.0 2.0 ![]()
![]() 28g/mol 14 40 1:3
28g/mol 14 40 1:3
【解析】
(1)含氢原子为0.2×6.02×1024个,则氢原子的物质的量为![]() ,则NH4HCO3的物质的量=2mol×
,则NH4HCO3的物质的量=2mol×![]() =0.4mol,其质量=0.4mol ×79g/mol=31.6g;其中含氧原子的物质的量=0.4mol×3=1.2mol;3.6克水的物质的量=
=0.4mol,其质量=0.4mol ×79g/mol=31.6g;其中含氧原子的物质的量=0.4mol×3=1.2mol;3.6克水的物质的量=![]() =0.2mol,一个水分子中含有10个质子,则0.2mol水中含有质子数为0.2mol×10×NA=2NA,
=0.2mol,一个水分子中含有10个质子,则0.2mol水中含有质子数为0.2mol×10×NA=2NA,
答案为:31.6克;1.2mol;2NA;
(2)由浓溶液配制稀溶液,溶质的物质的量不变,可用稀释公式解题,设需要12mol·L-1氢氧化钠溶液的体积为V,则12mol·L-1V=0.6mol·L-1×100mL,则V=5.0ml;配制成0.5mol·L-1的氢氧化钠溶液100mL,溶质氢氧化钠的物质的量=0.5mol·L-1×0.1L=0.05mol,其质量为0.05mol×40g/mol=2.0g,
答案为:5.0;2.0;
(3)将标况下aLHCl气体的物质的量=![]() =
=![]() ,盐酸溶液的体积为1L,则所得溶液物质的量浓度为
,盐酸溶液的体积为1L,则所得溶液物质的量浓度为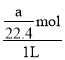 =
=![]() mol/L;根据c=
mol/L;根据c=![]() ,该溶液中溶质的质量分数
,该溶液中溶质的质量分数![]() =
= =
=![]() ,
,
答案为:![]() ;
;![]() ;
;
(4)在标准状况下,1molA的体积为22.4L,则1molA的质量=![]() ,则摩尔质量是28g/mol;同温同压下,气体的密度之比等于摩尔质量之比,该气体相对于氢气的密度是
,则摩尔质量是28g/mol;同温同压下,气体的密度之比等于摩尔质量之比,该气体相对于氢气的密度是![]() =14;在标准状况下,由CO和CO2组成的混合气体为6.72L,混合气体的物质的量=
=14;在标准状况下,由CO和CO2组成的混合气体为6.72L,混合气体的物质的量=![]() =0.3mol,质量为12g,此混合气体的平均相对分子质量=
=0.3mol,质量为12g,此混合气体的平均相对分子质量=![]() =40g/mol,根据十字交叉法:
=40g/mol,根据十字交叉法:
 ,则
,则![]() ,
,
答案为:28g/mol;14;40;1:3。

【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2