题目内容
【题目】下表是元素周期表的一部分,表中字母分别代表一种元素。回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | a | b | c | d | ||||
3 | e | f | g | x | y | z |
(1)表中所标元素,最活泼的金属元素形成简单离子符号为____;最不活泼的元素的原子结构示意图为 _____;其中一种元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该盐是_______。
(2)写出两种满足下列条件的物质______(写化学式)。
①由c、x、e组成的;②含有共价键的离子化合物。
(3)g、x、y的气态氢化物,最稳定的是______(填化学式)。
(4)表中元素的最高价氧化物的水化物中:酸性最强的是______(填化学式,下同);碱性最强的是_______,这两种物质反应的离子方程式为_________。
(5)推测元素的非金属性:a ______ g(填“>”或“<”)。利用图装置设计实验,证明推测结论。
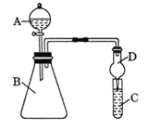
①仪器A的名称为___________,干燥管D的作用是______________。
②填空。
装置内试剂 | C中发生反应的化学方程式 | ||
A | B | C | |
稀硫酸 | 碳酸钠 | _______ | _______ |
【答案】Na+ ![]() NH4NO3 Na2SO3、Na2SO4 HCl HClO4 NaOH H++OH-=H2O > 分液漏斗 防止倒吸 Na2SiO3溶液 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3或者生成NaHCO3
NH4NO3 Na2SO3、Na2SO4 HCl HClO4 NaOH H++OH-=H2O > 分液漏斗 防止倒吸 Na2SiO3溶液 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3或者生成NaHCO3
【解析】
首先根据元素在周期表中的位置判断出元素种类,然后结合元素周期律以及相关物质的性质、实验原理分析解答。
根据元素在周期表中的位置可知a是C,b是N,c是O,d是F,e是Na,f是Al,g是Si,x是S,y是Cl,z是Ar。则
(1)表中所标元素,最活泼的金属元素是Na,形成简单离子符号为Na+;最不活泼的元素是稀有气体元素Ar,原子结构示意图为![]() ;其中一种元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素为N,生成的盐是NH4NO3。
;其中一种元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素为N,生成的盐是NH4NO3。
(2)①由O、Na、S组成的;②含有共价键的离子化合物,该化合物是Na2SO3、Na2SO4。
(3)同周期自左向右非金属性逐渐增强,氢化物的稳定性逐渐增强,g、x、y的气态氢化物,最稳定的是HCl。
(4)非金属性越强,最高价含氧酸的酸性越强,则表中元素的最高价氧化物的水化物中:酸性最强的是HClO4;金属性越强,最高价氧化物水化物的碱性越强,碱性最强的是NaOH,这两种物质反应的离子方程式为H++OH-=H2O。
(4)同主族从上到下非金属性逐渐减弱,则元素的非金属性:C>Si。
①根据仪器构造可知仪器A的名称为分液漏斗,干燥管D的作用是防止倒吸。
②要验证碳元素非金属性强于硅元素,可以利用较强酸制备较弱酸来证明。稀硫酸和碳酸钠溶液反应生成二氧化碳,通入硅酸钠溶液中产生硅酸沉淀即可证明,则C中试剂是硅酸钠溶液,C中发生反应的化学方程式为Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案