题目内容
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为___________________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是_________(填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式: ___NaCl+___H2O 电解 NaClO3+_________。
②II中转化的基本反应类型是____________________,该反应过程能析出KClO3晶体而无其它晶体析出的原因是_______________________________。
(4)一定条件,在水溶液中1 mol Cl-、![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。

①D是__________________(填离子符号)。
②B→A+C反应的离子方程式为______________________。
【答案】![]() b c 1 3 3H2 复分解反应 室温下,氯酸钾在水中的溶解度明显小于其它晶体 ClO4- 3ClO- = ClO3- + 2Cl-
b c 1 3 3H2 复分解反应 室温下,氯酸钾在水中的溶解度明显小于其它晶体 ClO4- 3ClO- = ClO3- + 2Cl-
【解析】
(1)与氯元素同族的短周期元素只有F原子,它的结构示意图为![]() ,
,
故答案为:![]() ;
;
(2)卤族元素最外层电子数相等,但随着原子序数增大,原子半径增大,原子核对最外层电子吸引力减小,其非金属性减弱,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,故选bc,
故答案为:bc;
(3)①根据氧化还原反应得失电子数相等可推断出,I中反应的总化学方程式为NaCl+3H2O 电解 NaClO3+3H2↑,
故答案为:1,3,3H2;
②NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度肯定小于其它晶体,所以先析出KClO3,
故答案为:复分解反应;室温下KClO3在水中的溶解度明显小于其它晶体;
(4)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-,故答案为:ClO4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,
故答案为:3ClO-=ClO3-+2Cl-。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】下列物质的分类中,所属关系不符合“X包含Y、Y包含Z”的有
选项 | X | Y | Z |
A | 芳香族化合物 | 芳香烃的衍生物 |
|
B | 脂肪族化合物 | 链状烃的衍生物 | CH3COOH(乙酸) |
C | 环状化合物 | 芳香族化合物 | 苯的同系物 |
D | 不饱和烃 | 芳香烃 |
|
A. A B. B C. C D. D
【题目】下表是元素周期表的一部分,表中字母分别代表一种元素。回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | a | b | c | d | ||||
3 | e | f | g | x | y | z |
(1)表中所标元素,最活泼的金属元素形成简单离子符号为____;最不活泼的元素的原子结构示意图为 _____;其中一种元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该盐是_______。
(2)写出两种满足下列条件的物质______(写化学式)。
①由c、x、e组成的;②含有共价键的离子化合物。
(3)g、x、y的气态氢化物,最稳定的是______(填化学式)。
(4)表中元素的最高价氧化物的水化物中:酸性最强的是______(填化学式,下同);碱性最强的是_______,这两种物质反应的离子方程式为_________。
(5)推测元素的非金属性:a ______ g(填“>”或“<”)。利用图装置设计实验,证明推测结论。
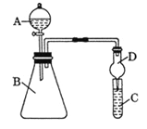
①仪器A的名称为___________,干燥管D的作用是______________。
②填空。
装置内试剂 | C中发生反应的化学方程式 | ||
A | B | C | |
稀硫酸 | 碳酸钠 | _______ | _______ |