题目内容
【题目】完成下列题目
(1)现有以下物质 ① 酒精 ②盐酸 ③熔融KCl ④KOH固体 ⑤蔗糖 ⑥铜 ⑦稀H2SO4溶液
以上物质中属于电解质的是(填序号)________________
(2)同温同压下,同体积的CO2和CO,它们的分子数之比为____________ ,密度之比为_____________。
(3)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒直径的范围是___________________。
(4)下列物质:①Cl2;②Na2CO3;③NaHCO3;④K—Na合金;⑤Na。
广泛用于玻璃、造纸的是______________(填编号,下同)
可用作原子反应堆的导热剂的是________________________。
(5)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):
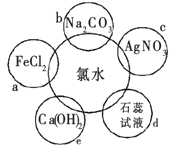
上述反应中发生了氧化还原反应的是:________(填“a”、“b”、“c”或“e”)。
【答案】③④1:111:71-100nm②④ae
【解析】
(1)① 酒精是非电解质;②盐酸是混合物,不是电解质,也不是非电解质;③熔融KCl是电解质;④KOH固体是电解质;⑤蔗糖是非电解质;⑥铜是单质,不是电解质,也不是非电解质; ⑦稀H2SO4溶液 是混合物,不是电解质,也不是非电解质;属于电解质的是③④;
(2)同温同压下同体积的CO2和CO,物质的量之比为1∶1,则分子数之比为1∶1;由ρ=![]() 可知密度之比等于质量之比,为11∶7;
可知密度之比等于质量之比,为11∶7;
(3)因透明的红褐色是胶体,胶体的粒子直径1nm~~100nm;
(4)高温下,碳酸钠和二氧化硅反应生成硅酸钠,碳酸钠呈碱性,还可以用于制造肥皂、造纸、纺织工业,故答案为②;K-Na合金具有良好的导热性,用作原子反应堆的导热剂,故答案为④;
(5)氯水中存在反应Cl2+H2O=H++Cl-+HClO,溶液中存在Cl2、HClO、H+、Cl-等粒子,氯气具有氧化性,可与氯化亚铁发生2Fe2++Cl2═2Fe3++2Cl-,是氧化还原反应;氯气和与氢氧化钙反应生成氯化钙和次氯酸钙,为制备漂白粉的主要反应,方程式为2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,是氧化还原反应,涉及氧化还原反应的为ae。