题目内容
25℃时,某酸HA:Ka=1.0×10-7,已知:溶液的酸度AG=lg[c(H+)/c(OH-)]
(1)HA的电离方程式为 。
(2)0.1 mol·L-1HA溶液中,c(H+)= ,AG= 。
(3)保持25℃,下列方法能使HA溶液的电离度、溶液pH都增大的是 (填字母)
A.加水稀释 B.加少量盐NaA固体 C.加少量NaOH固体
(1)HA的电离方程式为 。
(2)0.1 mol·L-1HA溶液中,c(H+)= ,AG= 。
(3)保持25℃,下列方法能使HA溶液的电离度、溶液pH都增大的是 (填字母)
A.加水稀释 B.加少量盐NaA固体 C.加少量NaOH固体
(1)HA H++A- (2)10-4mol/L 6 (3)A C
H++A- (2)10-4mol/L 6 (3)A C
 H++A- (2)10-4mol/L 6 (3)A C
H++A- (2)10-4mol/L 6 (3)A C
|
 H++A-。(2)
H++A-。(2)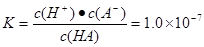 ,由于c(HA)=0. 1 mol/LHA溶液中,解得c(H+)=10-4mol/L。c(OH-)=10-10mol/L,所以AG=6.(3)保持25℃,A.加水稀释HA溶液的电离度增大,由于c(H+)减小,所以溶液pH增大。正确。B.加少量盐NaA固体,电离平衡HA
,由于c(HA)=0. 1 mol/LHA溶液中,解得c(H+)=10-4mol/L。c(OH-)=10-10mol/L,所以AG=6.(3)保持25℃,A.加水稀释HA溶液的电离度增大,由于c(H+)减小,所以溶液pH增大。正确。B.加少量盐NaA固体,电离平衡HA H++A-逆向移动,HA溶液的电离度减小,c(H+)减小,溶液pH增大。错误。C.加少量NaOH固体,电离平衡HA
H++A-逆向移动,HA溶液的电离度减小,c(H+)减小,溶液pH增大。错误。C.加少量NaOH固体,电离平衡HA H++A-正向移动,HA溶液的电离度增大,由于不断消耗H+,所以c(H+)减小,溶液pH增大。正确。考点:+)与AG的关系、外界条件对电离平衡的影响的知识。
H++A-正向移动,HA溶液的电离度增大,由于不断消耗H+,所以c(H+)减小,溶液pH增大。正确。考点:+)与AG的关系、外界条件对电离平衡的影响的知识。
练习册系列答案
相关题目

 Mg2+(aq)+ 2OH-(aq)
Mg2+(aq)+ 2OH-(aq)

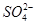 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)