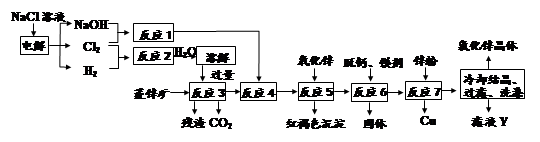题目内容
海水的综合利用可以制备金属钠和镁,其流程如下图所示:
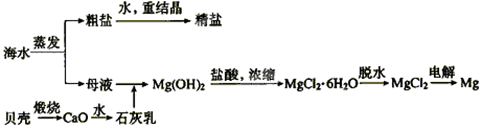
(1)上述流程中生成氢氧化镁沉淀的离子方程式为 。氢氧化镁沉淀和盐酸反应的离子方程式为 。
(2)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:
溶解时:____________;过滤时:____________;蒸发时:______________。

(1)上述流程中生成氢氧化镁沉淀的离子方程式为 。氢氧化镁沉淀和盐酸反应的离子方程式为 。
(2)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:
溶解时:____________;过滤时:____________;蒸发时:______________。
(每空2分,共10分) (1)Mg2++Ca(OH)2= Mg(OH)2+Ca2;Mg(OH)2 + 2H+ = Mg2+ + 2H2O
(2)搅拌,加快固体溶解速率;引流,溶液沿玻棒流下;搅拌,使溶液均匀受热;
(2)搅拌,加快固体溶解速率;引流,溶液沿玻棒流下;搅拌,使溶液均匀受热;
试题分析:(1)石灰乳与镁离子反应即生成氢氧化镁沉淀,则上述流程中生成氢氧化镁沉淀的离子方程式为Mg2++Ca(OH)2= Mg(OH)2+Ca2;氢氧化镁是碱,能和盐酸发生中和反应,则反应的离子方程式为Mg(OH)2 + 2H+=Mg2+ + 2H2O。
(2)溶解时通过玻璃棒的搅拌加快固体溶解速率;过滤时通过玻璃棒的引流使溶液沿玻棒流下;蒸发时通过玻璃棒的搅拌,使溶液均匀受热。
点评:该题是基础性试题的考查,难度不大,主要是考查学生对离子方程式书写的了解掌握程度以及玻璃棒在基本实验操作中的作用,有利于培养学生的规范答题能力。

练习册系列答案
相关题目