题目内容
17.图中的每一方格表示有关的一种物质,其A、C为无色气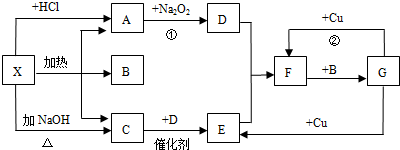
填写下列空白:
(1)物质X可以是(NH4)2CO3 或或NH4HCO3,C是NH3,F是NO2.
(2)A→D的化学方程式是2Na2O2+2CO2═2Na2CO3+O2.
C→E的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
G→F的离子方程式是Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
分析 X既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3;气体A能与过氧化钠,应是二氧化碳与过氧化钠反应,故A为CO2,则X应为碳酸铵或碳酸氢铵,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,通过验证符合转化关系,结合物质的性质进行解答.
解答 解:X既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3;气体A能与过氧化钠,应是二氧化碳与过氧化钠反应,故A为CO2,则X应为碳酸铵或碳酸氢铵,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,
(1)由上述分析可知,X为(NH4)2CO3 或NH4HCO3,C为NH3,F为NO2,
故答案为:(NH4)2CO3 或NH4HCO3;NH3;NO2;
(2)A→D为二氧化碳和过氧化钠的反应,反应方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
C→E为氨气的催化氧化,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
G→F铜和浓硝酸反应生成硝酸铜、二氧化氮和水,离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
点评 本题考查无机物的推断,为高频考点,题目难度中等,试题侧重于学生的分析能力的考查,注意X能与酸、碱反应生成气体A、C为解答本题的突破口,然后利用转化关系推出各物质,试题培养了学生的分析、理解能力及逻辑推理能力.

| A. | 盐类的水解过程是中和反应的逆过程,是吸热过程 | |
| B. | 易水解的盐溶于水后,都抑制了水的电离 | |
| C. | 易水解的盐溶液中,水电离出的以游离态存在的H+和OH-的浓度永远相等 | |
| D. | 易水解的盐溶液肯定不是中性的 |
| A. | 实验室中“通风厨”能排出有害的气体,能防止有害气体污染大气环境 | |
| B. | 减少碳氢化合物、氮氧化物的排放可以有效的防止光化学烟雾的产生 | |
| C. | 处理废弃塑料制品较为合理的方法是用化学方法将废弃塑料加工成防水涂料或汽油 | |
| D. | 对废弃电池进行集中回收后处理的主要目的是防止重金离子的污染 |
| A. | 电解时可以精铜为阳极,以CuSO4溶液为电解液 | |
| B. | 电解时阴极发生还原反应 | |
| C. | 粗铜连接电源负极,其电极反应是Cu-2e-=Cu2+ | |
| D. | 电解结束后,电解质溶液的浓度保持不变 |
| A. | 甲醛 | B. | 维生素E | C. | 苯甲酸及其钠盐 | D. | 柠檬酸 |
| A. | 二氧化碳增多使太阳辐射到地球表面的能量增多 | |
| B. | 二氧化碳等气体能释放能量,使大气层的温度升高 | |
| C. | 氟氯烃等大量排放,破坏臭氧层引起的 | |
| D. | 二氧化碳、甲烷等温室气体产生温室效应,使大气温度升高,加速冰层融化 |
| A. | 铝与CuSO4溶液反应:3Al+2Cu2+═2Cu+3Al3+ | |
| B. | 向Ba(OH)2溶液中加过量NaHCO3溶液:HCO3-+Ba2++OH-=H2O+BaCO3↓ | |
| C. | 澄清石灰水与盐酸反应:H++OH-=H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═4NH4++Al(OH)4- |
 .
.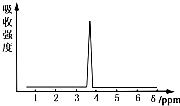 在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.
在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.