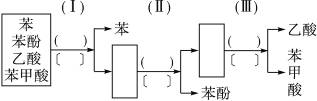
题目内容
(12分)实验室用浓盐酸与二氧化锰共热制取氯气,其反应方程式为:MnO +4HCl(浓)
+4HCl(浓) MnCl
MnCl +2H
+2H O+Cl
O+Cl ↑。现将4.35 g MnO
↑。现将4.35 g MnO 跟足量36%的盐酸充分反应后,生成的氯气为多少克?
跟足量36%的盐酸充分反应后,生成的氯气为多少克?
 +4HCl(浓)
+4HCl(浓) MnCl
MnCl +2H
+2H O+Cl
O+Cl ↑。现将4.35 g MnO
↑。现将4.35 g MnO 跟足量36%的盐酸充分反应后,生成的氯气为多少克?
跟足量36%的盐酸充分反应后,生成的氯气为多少克?3.55 g
盐酸足量,MnO 全部反应,可依据方程式MnO
全部反应,可依据方程式MnO +4HCl
+4HCl MnCl
MnCl +
+
2H O+Cl
O+Cl ↑计算。设生成Cl
↑计算。设生成Cl 的质量为x。则有如下关系:
的质量为x。则有如下关系:
MnO ~Cl
~Cl
87 71
4.35 g x
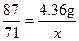 ,x="3.55" g
,x="3.55" g
 全部反应,可依据方程式MnO
全部反应,可依据方程式MnO +4HCl
+4HCl MnCl
MnCl +
+2H
 O+Cl
O+Cl ↑计算。设生成Cl
↑计算。设生成Cl 的质量为x。则有如下关系:
的质量为x。则有如下关系:MnO
 ~Cl
~Cl
87 71
4.35 g x
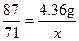 ,x="3.55" g
,x="3.55" g
练习册系列答案
相关题目
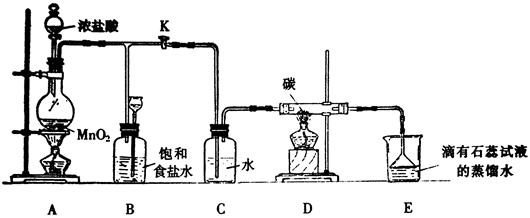
 。
。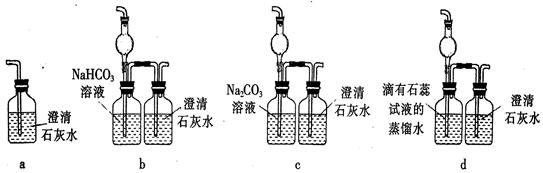

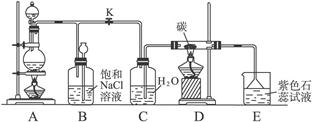

 (2008年上海卷,化学,18)设计学生试验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出)。下列气体的制取宜使用该装置的是
(2008年上海卷,化学,18)设计学生试验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出)。下列气体的制取宜使用该装置的是