题目内容
【题目】现有常温条件下甲、乙、丙三种溶液,甲为 0.1 mol·L-1 的 NaOH 溶液, 乙为 0.1 mol·L-1 的 HCl 溶液,丙为 0.1 mol·L-1 的 CH3COOH 溶液,试回答下列问题:
(1)甲溶液的 pH=_____。
(2)丙溶液中存在的电离平衡为_____(用电离方程式表示)。
(3)甲、乙、丙三种溶液中由水电离出的 c(OH-)的大小关系为 _____。
A. 甲=乙=丙 B. 甲=乙>丙 C.甲=乙<丙 D.无法判断
(4)某同学用甲溶液分别滴定 20.00 mL 乙溶液和 20.00 mL 丙溶液,得到如图所示两 条滴定曲线,请完成有关问题:
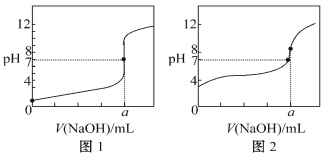
①甲溶液滴定丙溶液的曲线是_____(填“图 1”或“图 2”);
②a=_____mL。
(5)将等体积的甲溶液和丙溶液混合后,溶液呈_____(填“酸性”、“中性”或 “碱性”)。溶液中离子浓度大小顺序为_________。
【答案】13 CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() OH-+H+ C 图2 20.00 碱 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
OH-+H+ C 图2 20.00 碱 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【解析】
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,根据Kw=c(H+)c(OH-)计算溶液中c(H+),再根据pH=-lgc(H+)计算溶液的pH值;
(2)溶液中存在电离平衡,应存在弱电解质;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(4)①乙酸为弱电解质,滴定终点时,溶液呈碱性;
②NaOH和乙酸恰好反应时,消耗20mlNaOH溶液,生成弱酸强碱盐,溶液呈碱性;
(5)将等体积等浓度的NaOH溶液和CH3COOH溶液混合后,恰好生成CH3COONa,CH3COO-水解使所得溶液显碱性,再结合电荷守恒判断离子浓度大小。
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,故溶液中c(H+)=![]() mol/L=10-13mol/L,故该溶液的pH=-lg10-13=13;
mol/L=10-13mol/L,故该溶液的pH=-lg10-13=13;
(2)0.1molL-1的CH3COOH溶液中存在溶剂水、水为弱电解质,溶质乙酸为弱电解质,存在电离平衡为CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() OH-+H+;
OH-+H+;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离,乙酸是弱电解质,氢氧化钠、氯化氢是强电解质,所以相同物质的量浓度的乙酸和盐酸和氢氧化钠,盐酸中水电离出的氢氧根离子浓度小于醋酸,相同物质的量浓度的盐酸和氢氧化钠对水电离抑制程度相等,盐酸中水电离出的氢氧根离子浓度等于氢氧化钠溶液中水的电离,所以水电离出氢氧根离子浓度大小顺序是:丙>甲=乙,故答案为C;
(4)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2;
②滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,反应生成了醋酸钠,醋酸根离子发生水解,CH3COO-+H2O![]() CH3COOH+OH-,溶液显示碱性pH>7;
CH3COOH+OH-,溶液显示碱性pH>7;
(5)将等体积等浓度的NaOH溶液和CH3COOH溶液混合后,恰好生成CH3COONa,CH3COO-水解使所得溶液显碱性,即c(OH-)>c(H+);,溶液中存在的电荷守恒式为c(CH3COO-)+ c(OH-)=c(Na+)+c(H+);,则c(CH3COO-)<c(Na+),故所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。

【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率





