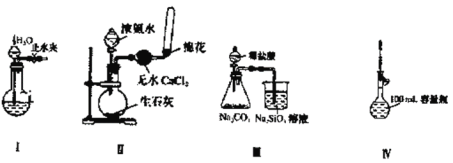
ЬтФПФкШн
ЁОЬтФПЁПIЁЂШчЭМЫљЪОЃЌXЪЧвЛжжЩњЛюжаГЃМћЕФН№ЪєдЊЫиЃЌAЁЂBЁЂCЁЂDЮЊЪЏФЋЕчМЋЃЌEЁЂFЗжБ№ЮЊЖЬжмЦкЯрСкСНжжЛюЦУН№ЪєжаЕФвЛжжЃЌЧвEФмгыNaOHШмвКЗДгІЁЃАДЭМЪОНгЭЈЯпТЗЃЌЗДгІвЛЖЮЪБМф(ЪЕбщжаЫљгаШмвКОљзуСП)ЁЃ

ЃЈ1ЃЉМзГиЪЧ___(ЬюЁАдЕчГиЁБЛђЁАЕчНтГиЁБЃЌЯТЭЌ]зАжУЃЛввГиЪЧ___зАжУЁЃ
ЃЈ2ЃЉDМЋЮЊ___(ЬюЁАвѕМЋЁБЛђЁАбєМЋЁБ)ЁЃ
ЃЈ3ЃЉЩеБжаШмвКЛсБфРЖЕФЪЧ_______(ЬюЁАaЁБЛђЁАbЁБ)ЃЛCМЋЩЯЕФЕчМЋЗДгІЪНЮЊ____ЁЃ
ЃЈ4ЃЉFМЋЩЯЕФЕчМЋЗДгІЪНЮЊЃК____ЁЃ
ЃЈ5ЃЉЕБЕчТЗжаЭЈЙ§0.02molЕчзгЪБЃЌBЕчМЋЩЯГСЛ§0.64gН№ЪєXЃЌдђXЮЊ___(ЬюдЊЫиЗћКХ)ЃЌМзГижаЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___ЁЃ
IIЁЂЃЈ1ЃЉДгЛдЭПѓжаНўШЁЭдЊЫиЃЌПЩгУFeCl3зїНўШЁМСЁЃ
ЂйЗДгІCu2S+4FeCl3=2CuCl2+4FeCl2+SЃЌУПЩњГЩ1molCuCl2ЃЌЗДгІжазЊвЦЕчзгЕФЪ§ФПЮЊ____ЃЛНўШЁЪБЃЌдкгабѕЛЗОГЯТПЩЮЌГжFe3+НЯИпХЈЖШЁЃгаЙиЗДгІЕФРызгЗНГЬЪНЪЧ___ЁЃ
ЂкНўШЁЙ§ГЬжаМгШыЯДЕгМСШмНтСђЪБЃЌЭдЊЫиЕФНўШЁТЪЕФБфЛЏМћШчЭМ1ЁЃЦфдвђЪЧ___ЁЃ

Ђл353KЪБЃЌЯђFeCl3НўШЁвКжаМгШыCuCl2ЃЌФмМгПьЭдЊЫиЕФНўШЁЫйТЪЃЌЦфЗДгІдРэПЩгУЛЏбЇЗНГЬЪНБэЪОЮЊЃК___ЃЌCuCl+FeCl3=CuCl2+FeCl2ЁЃ
ЃЈ2ЃЉЛдЭПѓПЩгЩЛЦЭПѓ(жївЊГЩЗжЮЊCuFeS2)ЭЈЙ§ЕчЛЏбЇЗДгІзЊБфЖјГЩЃЌгаЙизЊЛЏМћШчЭМ2ЁЃзЊЛЏЪБе§МЋЕФЕчМЋЗДгІЪНЮЊ___ЁЃ

ЁОД№АИЁПЕчНтГи дЕчГи вѕМЋ a 2Cl--2e-=Cl2Ёќ 2H2O+2e-=H2Ёќ+2OH- Cu 2CuSO4+2H2O![]() 2Cu+O2Ёќ+2H2SO4 2NA 4Fe2++O2+4H+=4Fe3++2H2O СђИВИЧдкCu2SБэУцЃЌзшАСЫНўШЁ Cu2S+2 CuCl2=4CuCl+S 2 CuFeS2+6H++2e-=Cu2S+2Fe2++3H2SЁќ
2Cu+O2Ёќ+2H2SO4 2NA 4Fe2++O2+4H+=4Fe3++2H2O СђИВИЧдкCu2SБэУцЃЌзшАСЫНўШЁ Cu2S+2 CuCl2=4CuCl+S 2 CuFeS2+6H++2e-=Cu2S+2Fe2++3H2SЁќ
ЁОНтЮіЁП
IЁЂEЁЂFЗжБ№ЮЊЖЬжмЦкЯрСкСНжжЛюЦУН№ЪєжаЕФвЛжжЃЌЧвEФмгыNaOHШмвКЗДгІЃЌЫЕУїEЪЧН№ЪєТСЃЌFЪЧН№ЪєУОЃЌввзАжУЮЊдЕчГиЃЌЦфжаAlзїИКМЋЃЌMgзїе§МЋЃЌCЪЧбєМЋЃЌDЪЧвѕМЋЃЌAЪЧбєМЋЃЌBЪЧвѕМЋЃЌОнДЫХаЖЯЃЛ
IIЁЂЃЈ1ЃЉЂйИљОнЗДгІЗНГЬЪНХаЖЯЕчзгзЊвЦЕФЪ§СПЃЛ
ЂкЩњГЩЕФСђИВИЧдкCu2SБэУцЃЛ
Ђл353KЪБЃЌЯђFeCl3НўШЁвКжаМгШыCuCl2ЃЌCuCl2гыCu2SЗДгІЩњГЩCuClЃЌCuClгыFeCl3ЗДгІЩњГЩCuCl2КЭFeCl2ЃЛ
ЃЈ2ЃЉРћгУдЕчГиЕФЙЄзїдРэХаЖЯЃЌИКМЋЪЇЕчзгЗЂЩњбѕЛЏЗДгІЃЌе§МЋЕУЕчзгЗЂЩњЛЙдЗДгІЃЛ
EЁЂFЗжБ№ЮЊЖЬжмЦкЯрСкСНжжЛюЦУН№ЪєжаЕФвЛжжЃЌЧвEФмгыNaOHШмвКЗДгІЃЌЫЕУїEЪЧН№ЪєТСЃЌFЪЧН№ЪєУОЃЌввзАжУЮЊдЕчГиЃЌЦфжаAlзїИКМЋЃЌMgзїе§МЋЃЌCЪЧбєМЋЃЌDЪЧвѕМЋЃЌAЪЧбєМЋЃЌBЪЧвѕМЋЃЌОнДЫХаЖЯЃЛ
ЃЈ1ЃЉгЩЗжЮіПЩжЊМзГиЪЧЕчНтГиЃЌввГиЪЧдЕчГиЃЛ
ЃЈ2ЃЉDМЋЮЊвѕМЋЃЛ
ЃЈ3ЃЉDЪЧвѕМЋЃЌИУЕчМЋЩЯВњЩњЧтЦјЃЌ AжаТШРызгЪЇЕчзгБфГЩТШЦјЃЌФмНЋЕтРызгбѕЛЏЮЊЕтЕЅжЪЃЌгіЕНЕэЗлБфРЖЩЋЃЌЫљвдЩеБжаШмвКЛсБфРЖЕФЪЧa ЃЌCМЋЮЊбєМЋЃЌЕчМЋЗДгІЪНЮЊ2Cl--2e-=Cl2ЁќЃЛ
ЃЈ4ЃЉгЩЗжЮіПЩжЊFЪЧН№ЪєУОЃЌзїе§МЋЃЌЫЎжаЕФЧтЕУЕчзгЩњГЩЧтЦјЃЌЕчМЋЗДгІЮЊЃК2H2O+2e-=H2Ёќ+2OH-ЃЛ
ЃЈ5ЃЉЩшXЕФФІЖћжЪСПЮЊMЃЌЕчНтЪБЃЌ2X2++2e-=XЃЌЕчТЗжаЭЈЙ§0.02molЕчзгЪБЃЌn(X)=0.01mol=![]() ,дђM=64g/molЃЌМДXЮЊCuЃЌМзГижаЕФЗДгІЮЊЃК2CuSO4+2H2O
,дђM=64g/molЃЌМДXЮЊCuЃЌМзГижаЕФЗДгІЮЊЃК2CuSO4+2H2O![]() 2Cu+O2Ёќ+2H2SO4ЃЛ
2Cu+O2Ёќ+2H2SO4ЃЛ
IIЁЂЃЈ1ЃЉЂйЗДгІЮЊCu2S+4FeCl3=2CuCl2+4FeCl2+SЃЌCuДг+1МлЩ§ИпЕН+2МлЃЌSДг-2МлЩ§ИпЕН0МлЃЌFeДг+3МлНЕЕЭЕН+2МлЃЌЩњГЩ2molCuCl2ЃЌЕчзгзЊвЦ4molЃЌФЧУДУПЩњГЩ1molCuCl2ЃЌЕчзгзЊвЦ2molЕчзгзЊвЦ2NAЃЛFe2+КмШнвзБЛбѕЛЏЃЌЗЂЩњЗДгІ4Fe2++O2+4H+=4Fe3++2H2OЃЌвђЖјНўШЁЪБЃЌдкгабѕЛЗОГЯТПЩЮЌГжFe3+НЯИпХЈЖШЃЛ
ЂкгЩЭМПЩжЊЃЌЮДМгШыЯДЕгМСШмНтСђЪБЃЌЭЕФНўШЁТЪЕЭЪЧгІЮЊЩњГЩЕФСђИВИЧдкCu2SБэУцЃЌзшАСЫНўШЁЃЛ
Ђл353KЪБЃЌЯђFeCl3НўШЁвКжаМгШыCuCl2ЃЌCuCl2гыCu2SЗДгІЩњГЩCuClЃЌCuClгыFeCl3ЗДгІЩњГЩCuCl2КЭFeCl2ЃЛЗЂЩњЕФЗДгІЮЊCu2S+2 CuCl2=4CuCl+SЃЌCuCl+FeCl3=CuCl2+FeCl2ЃЛ
ЃЈ2ЃЉгЩЛЦЭПѓ(жївЊГЩЗжЮЊCuFeS2)ЭЈЙ§ЕчЛЏбЇЗДгІзЊЛЏЖјГЩЃЌе§МЋЩЯЕУЕчзгЃЌЗЂЩњЛЙдЗДгІЃЌЕчМЋЗДгІЮЊЃК2 CuFeS2+6H++2e-=Cu2S+2Fe2++3H2SЁќЁЃ

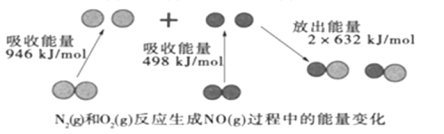
 УћЪІЕуВІОэЯЕСаД№АИ
УћЪІЕуВІОэЯЕСаД№АИ гЂВХМЦЛЎЦкФЉЕїбаЯЕСаД№АИ
гЂВХМЦЛЎЦкФЉЕїбаЯЕСаД№АИЁОЬтФПЁПЯТЪіЪЕбщжаОљгаКьзиЩЋЦјЬхВњЩњЃЌЖдБШЗжЮіЫљЕУНсТлВЛе§ШЗЕФЪЧЃЈ ЃЉ
|
|
|
Ђй | Ђк | Ђл |
A.гЩЂйжаЕФКьзиЩЋЦјЬхЃЌЭЦЖЯВњЩњЕФЦјЬхвЛЖЈЪЧЛьКЯЦјЬх
B.КьзиЩЋЦјЬхВЛФмБэУїЂкжаФОЬПгыХЈЯѕЫсЗЂЩњСЫЗДгІ
C.гЩЂлЫЕУїХЈЯѕЫсОпгаЛгЗЂадЃЌЩњГЩЕФКьзиЩЋЦјЬхЮЊЛЙдВњЮя
D.ЂлЕФЦјЬхВњЮяжаМьВтГіCO2ЃЌгЩДЫЫЕУїФОЬПвЛЖЈгыХЈЯѕЫсЗЂЩњСЫЗДгІ