题目内容
4.实验室用氢氧化钠固体配制1.0mol/L的NaOH溶液500mL,回答下列问题:(1)请简要叙述该实验的主要实验步骤:
①计算;②称量;
③溶解;④移液;
⑤洗涤;⑥定容.
(2)所需仪器为:容量瓶(规格为500 mL)、托盘天平,还需要哪些实验仪器才能完成该实验,请写出:烧杯、玻璃棒、胶头滴管
(3)下列操作对所配溶液的浓度有何影响?(填写字母)偏大的有AC;偏小的有;无影响的有.
A.称量时使用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶中移液时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线.
分析 (1)用氢氧化钠固体配制1.0mol/L的NaOH溶液500mL主要步骤为计算、称量、溶解、移液、洗涤、定容;
(2)配制溶液需选用500ml的容量瓶,需用到的仪器有:托盘天平、烧杯、玻璃棒、胶头滴管;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断.
解答 解:(1)主要步骤为计算、称量、溶解、移液、洗涤、定容,故答案为:计算;称量;溶解;移液;洗涤;定容;
(2)实验室用氢氧化钠固体配制1.0 mol/L的NaOH溶液500 mL,故配制溶液需选用500ml的容量瓶,需用到的仪器有:托盘天平、烧杯、玻璃棒、胶头滴管,缺少烧杯、玻璃棒、胶头滴管,故答案为:500 mL;烧杯、玻璃棒、胶头滴管;
(3)A.称量时使用了生锈的砝码,称取的溶质的质量偏大,溶质的物质的量偏大,溶液的浓度偏大;
B.将NaOH放在纸张上称量,氢氧化钠潮解,称取的氢氧化钠的质量偏小,溶质的物质的量偏小,溶液的浓度偏小;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,冷却后溶液的体积偏小,溶液的浓度偏大;
D.往容量瓶中移液时,有少量液体溅出,溶质的物质的量偏小,溶液的浓度偏小;
E.未洗涤溶解NaOH的烧杯,溶质的物质的量偏小,溶液的浓度偏小;
F.定容时仰视刻度线,溶液的体积偏大,溶液的浓度偏小;
G.容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的体积不会产生影响,溶液的浓度不变;
H.定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线,溶液的浓度偏小;
所以偏大的有:AC;偏小的有:BDEFH,无影响的有G;
故答案为:AC;BDEFH;G.
点评 本题考查了一定物质的量浓度溶液的配制,注意从c=$\frac{n}{V}$理解配制原理,题目难度不大.

| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 氧化钙溶于水 |
| A. | “钡餐”中使用的硫酸钡是弱电解质 | |
| B. | 太阳能电池板中的硅在周期表中处于金属与非金属的交界位置 | |
| C. | 常用的自来水消毒剂有Cl2和二氧化氯,两者都含极性键 | |
| D. | “滴水穿石”不涉及化学变化 |
完成以下实验探究过程:
(1)提出假设:
假设1 该混合金属粉末中除铝外还含有Fe(或Cu)元素;
假设2 该混合金属粉末中除铝外还含有Cu(或Fe)元素;
假设3 该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案
基于假设3,设计出实验方案(不要在答题卡上作答).
(3)实验过程
根据(2)的实验方案,完成实验操作、预期现象和结论的有关问题.
| 编号 | 实验操作 | 预期现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用 | 样品部分溶解,并有气体放出 | |
| ② | 往试管A的剩余固体中加过量稀硫酸,充分反应后,静置.取上层清液于试管B中,剩余固体备用 | 固体部分溶解,并有气体放出,溶液呈浅绿色 | 可能含铁 (填元素名称,以下同) |
| ③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变黄色,加KSCN后显血红色 | 结合②可知,一定含 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色 沉淀产生. | 一定含铜. |
| A. | 豆浆 | B. | NaCl溶液 | C. | HCl | D. | 空气 |
(1)2CH3CHO$→_{①}^{NaOH}$CH3CH(OH)CH2CHO$→_{②}^{-H_{2}O}$CH3CH=CHCHO$\stackrel{③}{→}$CH3CH2CH2CHO
(2)
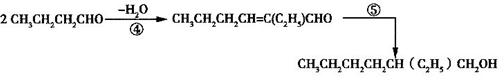
(3)利用邻苯二甲酸酸酐与2-乙基-1-乙醇合成DEHP
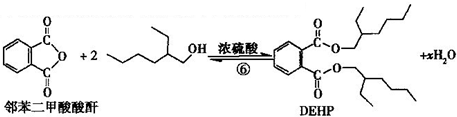
下列说法正确的是( )
| A. | 合成过程涉及加成、消去、酯化、聚合等类型的有机反应 | |
| B. | 步骤(1)中②反应发生的条件是在NaOH/醇溶液中加热,反应类型是消去反应 | |
| C. | 步骤(1)(2)连续操作时,③、⑤消耗H2物质的量相等 | |
| D. | ⑥反应方程式中产物H2O系数x=2,及时除去⑥中反应釜内的水可提高DEHP产率 |
| A. | 氟原子的结构示意图: | B. | 乙烯结构式:CH2=CH2 | ||
| C. | 乙炔球棍模型: | D. | NH3的电子式: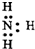 |
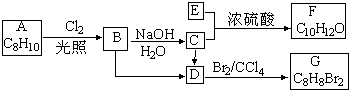
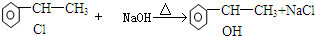 .
.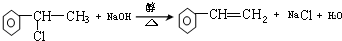 ,E+C→F
,E+C→F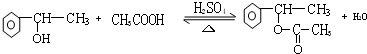
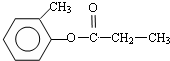
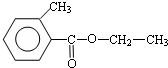
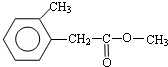
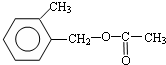
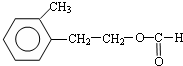
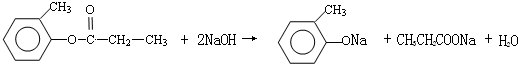 .
.