题目内容
10.CuSO4溶液是中学化学及工农业生产中常见的一种试剂.某同学利用制得的CuSO4溶液,进行以下实验探究.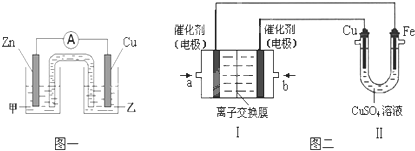
(1)图一是根据反应Zn+CuSO4=Cu+ZnSO4 设计成的锌铜原电池.电解质溶液甲是ZnSO4(填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是Cu2++2e-=Cu;.
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是O2(填“CH4”或“O2”),a处电极上发生的电极反应式是CH4-8e-+10OH-=CO32-+7H2O.
分析 (1)根据反应Zn+CuSO4=Cu+ZnSO4 设计成的锌铜原电池,则电解质溶液甲是电极为硫酸锌,锌失电子为负极,Cu为正极,该电极上是铜离子得到电子;
(2)实现铁上镀铜,Cu为阳极,则b为正极,a为负极,在燃料电池的负极上是甲烷失去电子的氧化反应.
解答 解:(1)根据反应Zn+CuSO4=Cu+ZnSO4 设计成的锌铜原电池,则锌失电子为负极,Cu为正极,该电极上是铜离子得到电子的还原反应,电极反应为Cu2++2e-=Cu,
故答案为:ZnSO4;Cu2++2e-=Cu;
②实现铁上镀铜,Cu为阳极,则b为正极,通入的气体O2,a为负极,通入甲烷,该电极上是甲烷失去电子,电极反应为CH4-8e-+10OH-=CO32-+7H2O;故答案为:O2;CH4-8e-+10OH-=CO32-+7H2O.
点评 本题考查学生原电池的构成条件以及燃料电池的工作原理、电镀池的工作原理知识,注意知识的归纳和梳理是解体的关键,难度中等.

练习册系列答案
相关题目
1.下列哪种说法可以证明反应.N2+3H2?2NH3已达到平衡状态( )
| A. | 1个N≡N键断裂的同时,有6个H-H键断裂 | |
| B. | 1个N≡N键断裂的同时,有3个H-H键断裂 | |
| C. | 1个N≡N键断裂的同时,有6个N-H键断裂 | |
| D. | 1个N≡N键断裂的同时,有6个N-H键形成 |
18.由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特性.以下各组粒子结构不相似的是( )
| A. | CO和N2 | B. | O3和SO2 | C. | CO2和N2O | D. | N2H4和C2H4 |
2.下列化合物中,属于芳香族化合物,且属于醇类的是( )
| A. | 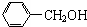 | B. |  | C. |  | D. | CH3OH |
19.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数目为0.02 NA | |
| B. | 常温常压下,2NA 个CO2分子占有的体积为44.8L | |
| C. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
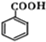 .
.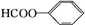 +2NaOH$\stackrel{△}{→}$HCOONa+
+2NaOH$\stackrel{△}{→}$HCOONa+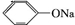 +H2O
+H2O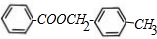 ;写出有机物C在Cu作催化剂的条件下与O2反应生成E的化学方程式:
;写出有机物C在Cu作催化剂的条件下与O2反应生成E的化学方程式: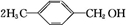 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O
+2H2O