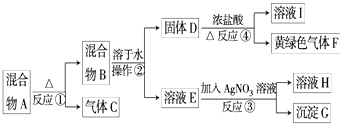
题目内容
【题目】化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.
(1)从物质的分类角度来看,不恰当的一种物质是 .
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式: .
(3)“三酸”常用于溶解金属和金属氧化物.“三酸”分别溶解Fe2O3的离子方程式为:;稀硫酸、稀盐酸溶解铁的离子方程式为: .
(4)烧碱、纯碱溶液均可吸收CO2 , 当含0.1mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①;②Na2CO3;
③;④NaHCO3 .
若通入的CO2在标准状况下体积为1.792L,则得到固体的组成的化学式和物质的量分别是;将该固体全部溶于水,A、当向其中加入含0.02mol Ca(OH)2的石灰水,生成沉淀的质量为g;写出该反
应总的离子方程式:;
B、当向其中加入含0.07mol Ca(OH)2的石灰水,生成沉淀的质量为g,写出该反应总的离子方程式: .
【答案】
(1)纯碱
(2)H++OH﹣=H2O、2H++CO ![]() =CO2↑+H2O
=CO2↑+H2O
(3)Fe2O3+6H+=2Fe3++3H2O;Fe+2H+=Fe2++H2↑
(4)NaOH和Na2CO3;Na2CO3和NaHCO3 ;Na2CO30.02mol和NaHCO30.06mol;2;Ca2++2OH﹣+2HCO ![]() =CaCO3↓+CO
=CaCO3↓+CO ![]() +2H2O;7;7Ca2++6OH﹣+6HCO3﹣+CO
+2H2O;7;7Ca2++6OH﹣+6HCO3﹣+CO ![]() =7CaCO3↓+6H2O
=7CaCO3↓+6H2O
【解析】解:(1)纯碱的只要成分是碳酸钠,属于盐,而碱为电离出的阴离子全部是氢氧根离子的化合物,碳酸钠电离出钠离子和碳酸根离子,所以答案是:纯碱;(2)硝酸、硫酸和盐酸都是强酸,烧碱为强碱,反应的离子方程式为H++OH﹣=H2O,强酸和碳酸钠反应生成二氧化碳和水,反应的离子方程式为2H++CO ![]() =CO2↑+H2O,所以答案是:H++OH﹣=H2O、2H++CO
=CO2↑+H2O,所以答案是:H++OH﹣=H2O、2H++CO ![]() =CO2↑+H2O.(3)“三酸”分别溶解Fe2O3的离子方程式为难溶于水的氧化铁和氢离子反应生成铁离子和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,稀硫酸和稀盐酸与铁反应实质是铁和氢离子反应生成亚铁离子和氢气:Fe+2H+=Fe2++H2↑,所以答案是:Fe2O3+6H+=2Fe3++3H2O,Fe+2H+=Fe2++H2↑;(4)0.1mol NaOH的溶液吸收一定量CO2后,根据吸收二氧化碳的量,当通入二氧化碳的量很少事,氢氧化钠过量,生成Na2CO3 , 故蒸干得到NaOH、Na2CO3;当CO2与NaOH溶液恰好完全反应时,则生成a2CO3 , 低温蒸干得到Na2CO3;当CO2稍过量时,会与部分Na2CO3反应生成NaHCO3 , 低温蒸干得到Na2CO3、NaHCO3;当CO2大量过量时,Na2CO3完全转化为NaHCO3 , 低温蒸干得到NaHCO3 , 故溶液低温蒸干得到固体的组成为:NaOH、Na2CO3或 Na2CO3或Na2CO3、NaHCO3或NaHCO3 , 当含0.1mol NaOH的溶液吸收0.08molCO2后发生的反应可以直平法写出,4CO2+5NaOH=Na2CO3+3NaHCO3+H2O,得到固体的组成的化学式和物质的量分别是Na2CO30.02mol和NaHCO30.06mol,将该固体Na2CO30.02mol和NaHCO30.06mol全部溶于水,A、当向其中加入含0.02mol Ca(OH)2的石灰水,先和碳酸氢钠溶液发生反应,碳酸氢钠和氢氧化钙向比较可知碳酸氢钠过量,发生反应Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O,生成沉淀的质量为0.02mol,质量=0.02mol×100g/mol=2g,B、当向其中加入含0.07mol Ca(OH)2的石灰水,发生反应Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O,0.06molNaHCO3 全部反应需要0.03molCa(OH)2 , 生成碳酸钠物质的量为:0.03mol,生成碳酸钙0.03mol,剩余氢氧化钙和碳酸钠反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,生成沉淀碳酸钙物质的量为0.04mol,则共生成碳酸钙物质的量为0.03mol+0.04mol=0.07mol,沉淀的质量=0.07mol×100g/mol=7g,反应的离子方程式为:7Ca2++6OH﹣+6HCO
=CO2↑+H2O.(3)“三酸”分别溶解Fe2O3的离子方程式为难溶于水的氧化铁和氢离子反应生成铁离子和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,稀硫酸和稀盐酸与铁反应实质是铁和氢离子反应生成亚铁离子和氢气:Fe+2H+=Fe2++H2↑,所以答案是:Fe2O3+6H+=2Fe3++3H2O,Fe+2H+=Fe2++H2↑;(4)0.1mol NaOH的溶液吸收一定量CO2后,根据吸收二氧化碳的量,当通入二氧化碳的量很少事,氢氧化钠过量,生成Na2CO3 , 故蒸干得到NaOH、Na2CO3;当CO2与NaOH溶液恰好完全反应时,则生成a2CO3 , 低温蒸干得到Na2CO3;当CO2稍过量时,会与部分Na2CO3反应生成NaHCO3 , 低温蒸干得到Na2CO3、NaHCO3;当CO2大量过量时,Na2CO3完全转化为NaHCO3 , 低温蒸干得到NaHCO3 , 故溶液低温蒸干得到固体的组成为:NaOH、Na2CO3或 Na2CO3或Na2CO3、NaHCO3或NaHCO3 , 当含0.1mol NaOH的溶液吸收0.08molCO2后发生的反应可以直平法写出,4CO2+5NaOH=Na2CO3+3NaHCO3+H2O,得到固体的组成的化学式和物质的量分别是Na2CO30.02mol和NaHCO30.06mol,将该固体Na2CO30.02mol和NaHCO30.06mol全部溶于水,A、当向其中加入含0.02mol Ca(OH)2的石灰水,先和碳酸氢钠溶液发生反应,碳酸氢钠和氢氧化钙向比较可知碳酸氢钠过量,发生反应Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O,生成沉淀的质量为0.02mol,质量=0.02mol×100g/mol=2g,B、当向其中加入含0.07mol Ca(OH)2的石灰水,发生反应Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O,0.06molNaHCO3 全部反应需要0.03molCa(OH)2 , 生成碳酸钠物质的量为:0.03mol,生成碳酸钙0.03mol,剩余氢氧化钙和碳酸钠反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,生成沉淀碳酸钙物质的量为0.04mol,则共生成碳酸钙物质的量为0.03mol+0.04mol=0.07mol,沉淀的质量=0.07mol×100g/mol=7g,反应的离子方程式为:7Ca2++6OH﹣+6HCO ![]() +CO
+CO ![]() =7CaCO3↓+6H2O,所以答案是:NaOH和Na2CO3 , Na2CO3和NaHCO3 ;Na2CO30.02mol和NaHCO30.06mol A、2g,Ca2++2OH﹣+2HCO
=7CaCO3↓+6H2O,所以答案是:NaOH和Na2CO3 , Na2CO3和NaHCO3 ;Na2CO30.02mol和NaHCO30.06mol A、2g,Ca2++2OH﹣+2HCO ![]() =CaCO3↓+CO
=CaCO3↓+CO ![]() +2H2O;
+2H2O;
B、7g,7Ca2++6OH﹣+6HCO ![]() +CO
+CO ![]() =7CaCO3↓+6H2O.
=7CaCO3↓+6H2O.

【题目】根据表中信息,判断下列叙述中正确的是( )
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① | Cl2 | FeBr2 | / | Cl﹣ | |
② | KClO3 | 浓盐酸 | / | Cl2 | |
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组反应当n(FeBr2):n(Cl2)≥ ![]() 一种元素被氧化、当n(FeBr2):n(Cl2)<
一种元素被氧化、当n(FeBr2):n(Cl2)< ![]() 两种元素被氧化
两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e﹣
D.表中③组反应的离子方程式为:2MnO ![]() +5H2O2+6H+═2Mn2++5O2↑+8H2O
+5H2O2+6H+═2Mn2++5O2↑+8H2O