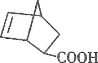
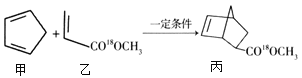题目内容
【题目】过量排放含氮物质会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
Ⅰ.对NO与O2反应的研究。
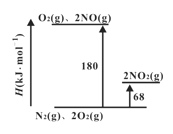
(1)已知氮氧化物转化过程中的焓的变化如下图所示,写出 NO转化为NO2的热化学方程式__________。
(2)2NO+O2![]() 2NO2的平衡常数表达式K=_______。其他条件不变,利用分子捕获器适当减少反应容器中NO2的含量,平衡常数K将_____(填“增大”、“减小”或“不变” )。
2NO2的平衡常数表达式K=_______。其他条件不变,利用分子捕获器适当减少反应容器中NO2的含量,平衡常数K将_____(填“增大”、“减小”或“不变” )。
(3)已知:2NO2(g)![]() N2O4(g) △H<0。在一定条件下,将2 mol NO和1 mol O2通入恒容密闭容器中进行反应,在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如下图所示。
N2O4(g) △H<0。在一定条件下,将2 mol NO和1 mol O2通入恒容密闭容器中进行反应,在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如下图所示。

①曲线c代表________的物质的量与温度的关系,x点对应的O2的转化率为________。
②根据上图可推测_________________。
A.2NO+O2![]() 2NO2的平衡常数:x点﹥y点
2NO2的平衡常数:x点﹥y点
B.y点时2NO+O2![]() 2NO2的反应速率:υ(正)﹤υ(逆)
2NO2的反应速率:υ(正)﹤υ(逆)
C.400~1200℃时,随着温度升高,N2O4体积分数不断增大
D.x点对应的NO的物质的量分数为4/11
Ⅱ.对废水中过量氨氮转化的研究。
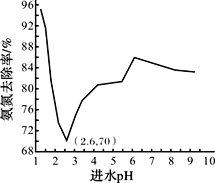
废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水,将其转化为无污染物质,不同进水pH对氨氮去除率的影响如图所示。
已知:ⅰ.HClO的氧化性比NaClO强;
ⅱ.NH3比NH4+更易被氧化。
(4)pH=1.25时,NaClO与NH4+反应生成N2等无污染物质,该反应的离子方程式______。
(5)进水pH为1.25~6.00范围内,氨氮去除率随pH升高发生图中变化的原因是_______。
【答案】2NO(g)+O2(g) ![]() 2NO2(g) △H= -112kJ·mol-1
2NO2(g) △H= -112kJ·mol-1 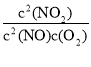 不变 NO2 60% AD 3HClO + 2NH4+ = N2↑ + 3Cl-+ 3H2O + 5H+(或3ClO-+ 2NH4+ = N2↑ +3Cl-+ 3H2O + 2H+) pH<2.6时,随着pH升高,NaClO含量增大,氧化性能降低,导致氨氮去除率下降;pH在2.6~6之间时,随着pH升高,氨氮废水中NH3含量增大,氨氮更易被氧化
不变 NO2 60% AD 3HClO + 2NH4+ = N2↑ + 3Cl-+ 3H2O + 5H+(或3ClO-+ 2NH4+ = N2↑ +3Cl-+ 3H2O + 2H+) pH<2.6时,随着pH升高,NaClO含量增大,氧化性能降低,导致氨氮去除率下降;pH在2.6~6之间时,随着pH升高,氨氮废水中NH3含量增大,氨氮更易被氧化
【解析】
(1)依据能量转化图的数据作答;
(2)平衡常数是指反应达到平衡时,各生成物平衡浓度的化学计量数次幂的乘积除以各反应物平衡浓度的化学计量数次幂的乘积所得的比值;平衡常数只和温度有关;
(3)①依据升高温度对反应2NO(g)+O2(g) ![]() 2NO2(g)的影响作答;依据x点的NO平衡时的物质的量,找出反应的氧气的物质的量,根据转化率公式求得结论;
2NO2(g)的影响作答;依据x点的NO平衡时的物质的量,找出反应的氧气的物质的量,根据转化率公式求得结论;
②A. 反应2NO(g)+O2(g) ![]() 2NO2(g)为放热反应,则随着温度的升高,反应的平衡常数减小;
2NO2(g)为放热反应,则随着温度的升高,反应的平衡常数减小;
B. 图中任何一点是平衡时的物质的物质的量;
C. 2NO2(g)![]() N2O4(g) △H<0,依据温度对平衡的影响作答;
N2O4(g) △H<0,依据温度对平衡的影响作答;
D. 列出三段式,求出NO的物质的量分数;
Ⅱ.(4)依据氧化还原反应规律作答;
(5)依据给定的已知信息分析。
(1)从转化过程的焓的变化情况可知,2NO(g)+O2(g) ![]() 2NO2(g) △H= -(180 kJ·mol-1-68 kJ·mol-1)=-112kJ·mol-1,故答案为:2NO(g)+O2(g)
2NO2(g) △H= -(180 kJ·mol-1-68 kJ·mol-1)=-112kJ·mol-1,故答案为:2NO(g)+O2(g) ![]() 2NO2(g) △H= -112kJ·mol-1;
2NO2(g) △H= -112kJ·mol-1;
(2)2NO+O2![]() 2NO2的平衡常数表达式K=
2NO2的平衡常数表达式K=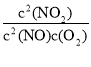 ;化学反应平衡常数只与温度有关,与反应物或生成物的浓度无关,因此其他条件不变,利用分子捕获器适当减少反应容器中NO2的含量,平衡常数K将不变;
;化学反应平衡常数只与温度有关,与反应物或生成物的浓度无关,因此其他条件不变,利用分子捕获器适当减少反应容器中NO2的含量,平衡常数K将不变;
(3)①2NO(g)+O2(g) ![]() 2NO2(g) △H= -112kJ·mol-1,升高温度,平衡向逆反应方向移动,则NO2的物质的量随温度的升高而减小,NO和O2的物质的量随温度的升高而增大,从图中可以看出,曲线c代表NO2的物质的量与温度的关系;曲线a代表NO的物质的量与温度的关系,x点处NO平衡时的物质的量为0.8mol,则转化的NO的物质的量为2mol-0.8mol=1.2mol,转化的O2的物质的量为
2NO2(g) △H= -112kJ·mol-1,升高温度,平衡向逆反应方向移动,则NO2的物质的量随温度的升高而减小,NO和O2的物质的量随温度的升高而增大,从图中可以看出,曲线c代表NO2的物质的量与温度的关系;曲线a代表NO的物质的量与温度的关系,x点处NO平衡时的物质的量为0.8mol,则转化的NO的物质的量为2mol-0.8mol=1.2mol,转化的O2的物质的量为![]() ×1.2mol=0.6mol,则转化率为
×1.2mol=0.6mol,则转化率为![]() ×100%=60%;
×100%=60%;
②A. 2NO(g)+O2(g) ![]() 2NO2(g)为放热反应,随着温度的升高,反应的平衡常数减小,从图中可以看出,Tx<Ty,则平衡常数比较:x点﹥y点,A项正确;
2NO2(g)为放热反应,随着温度的升高,反应的平衡常数减小,从图中可以看出,Tx<Ty,则平衡常数比较:x点﹥y点,A项正确;
B. 图中任何一点是平衡时的物质的物质的量,则υ(正)=υ(逆),B项错误;
C.2NO2(g)![]() N2O4(g) △H<0,则升高温度,平衡向逆反应方向移动,N2O4的体积分数降低,C项错误;
N2O4(g) △H<0,则升高温度,平衡向逆反应方向移动,N2O4的体积分数降低,C项错误;
D. x点NO、NO2平衡时的物质的量均为0.8mol,列出三段式如下:
2NO(g)+O2(g) ![]() 2NO2(g)
2NO2(g)
起始量(mol) 2 1 0
转化量(mol) 1.2 0.6 1.2
平衡量(mol) 0.8 0.4 0.8
2NO2(g)![]() N2O4(g)
N2O4(g)
起始量(mol)1.2 0
转化量(mol)0.4 0.2
平衡量(mol)0.8 0.2
则对应的NO的物质的量分数为![]() =
=![]() ,D项正确;
,D项正确;
故答案选AD;
Ⅱ.(4)pH=1.25时,NaClO氧化NH4+反应生成N2等无污染物质,自身还原为氯离子,3HClO + 2NH4+ = N2↑ + 3Cl-+ 3H2O + 5H+(或3ClO-+ 2NH4+ = N2↑ +3Cl-+ 3H2O + 2H+);
(5)根据已知i,pH<2.6时,随着pH升高,NaClO含量增大,氧化性能降低,导致氨氮去除率下降;根据已知ii,pH在2.6~6之间时,随着pH升高,氨氮废水中NH3含量增大,氨氮更易被氧化,所以进水pH为1.25~6.00范围内,氨氮去除率随pH升高发生图中变化。

 53随堂测系列答案
53随堂测系列答案【题目】碱式碳酸铜可用作木材防腐剂、水体杀藻剂等,研究性学习小组设计以下方案制备碱式碳酸铜并进行相关实验探究。
Ι.以铜屑为原料制备碱式碳酸铜的装置如下:
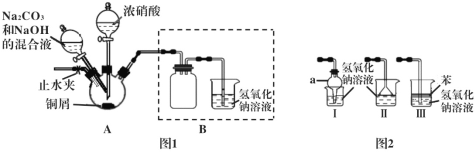
步骤1 连接好装置,检查装置的气密性,装药品。
步骤2 往三颈烧瓶中加入适量的浓硝酸,使铜屑完全反应。
步骤3 往步骤2反应后的溶液中加入一定比例的Na2CO3和NaOH的混合液,加热。
步骤4 将三颈烧瓶中的混合物过滤、洗涤、烘干,获得产物。
已知:ⅰ.碱式碳酸铜为草绿色或绿色结晶物,易溶于酸,不溶于水,在100℃的水中易分解;
ⅱ.NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O;
NO不能单独与NaOH溶液反应。
(1)步骤2中浓硝酸与铜屑反应的离子方程式为___________________。
(2)步骤2反应一段时间后,须打开止水夹,通入一段时间的空气,目的是_______。
(3)步骤3对装置A的加热方式最好采用____________。
(4)装置Ι中仪器a的名称为____,Ⅰ、Ⅱ、Ⅲ三个装置不能替代图1中B装置的是_____(填装置序号)。
(5)欲检验步骤4获得的产物中是否含有NO3-,所需的试剂可以是__________。
Ⅱ.探究在一定温度下,不同的原料配比对产物的影响,实验数据如下:
实验序号 | V[Cu(NO3)2] /mL (0.5 mo1·L-1) | V(NaOH) / mL (0.5 mo1·L-1) | V(Na2CO3)/ mL (0.25 mo1·L-1) | 沉淀数量 | 沉淀颜色 |
1 | 2.0 | 2.0 | 1.6 | + | 浅绿色 |
2 | 2.0 | 2.0 | 2.0 | + + | 浅绿色 |
3 | 2.0 | 2.0 | 2.4 | + + + | 蓝色 |
4 | 2.0 | 2.0 | 2.8 | + + + | 蓝色 |
注:“+”越多表示沉淀量越多
(6)分析表格数据可得:制备碱式碳酸铜最佳的原料配比n[Cu(NO3)2]:n(NaOH) : n(Na2CO3) =___。
Ⅲ.产物组成的测定
(7)碱式碳酸铜的成分有多种,化学式可表示为mCu(OH)2·n CuCO3。为测定Ι中所得碱式碳酸铜的组成,学习小组同学准确称取3.820 g样品溶于适量的硫酸中,加水配成l00 mL溶液,取l0.00 mL溶液于锥形瓶中,加适量水稀释,调节溶液pH至3~4,加入过量的KI(2 Cu2+ + 4 I- = 2 CuI↓ + I2),用0.l000 mol·L-1 Na2S2O3标准溶液滴定(2 S2O32- + I2 = 2I- + S4O62-),接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失。进行平行实验后,测得平均消耗Na2S2O3标准溶液的体积为35.00 mL。该碱式碳酸铜的化学式为_____