题目内容
【题目】已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1) ΔH=-571.6kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H=-2220kJmol-1
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为
A. 2:3 B. 1:3 C. 3:2 D. 3:1
【答案】A
【解析】假定0.5mol的全部是H2(g),则放出的热量为:142.9kJ。假定0.5mol的全部是C3H8(g),则放出的热量为:1110kJ。现在放出的热量为:723.2kJ,则可以用十字交叉法来求出氢气和丙烷的体积比:
十字交叉法: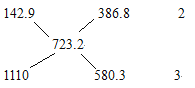
从以上过程可以看出:氢气和丙烷的体积比为:2:3,答案选A。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目

