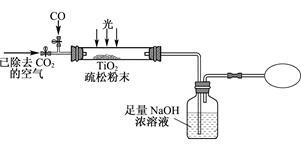
题目内容
(6分)热重分析法是程序控制温度下,测量物质的质量与温度的关系的一种实验技术。现有一CaC2O4·nH2O试样,分别在氮气气氛、氧气气氛中进行热重分析,得到如下热重(TG)曲线。
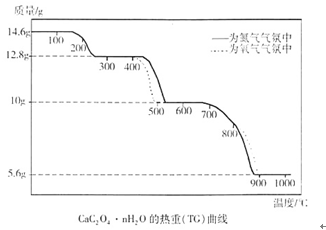
(1)图中曲线上有三个失重台阶,分别表示加热过程中依次发生了三个反应。根据第1步反应的失重数据计算试样CaC2O4·nH2O中的n值(精确到整数)为 。
(2)根据第2步反应的失重数据推测第2反应的化学方程式为 ;观察曲线说明氧气存在时有利于第2步反应进行,原因是 。
(3)第3步反应中释放的气体产物是 。观察曲线可判断出,氧气存在时不利于第3步反应进行,可能原因是 。

(1)图中曲线上有三个失重台阶,分别表示加热过程中依次发生了三个反应。根据第1步反应的失重数据计算试样CaC2O4·nH2O中的n值(精确到整数)为 。
(2)根据第2步反应的失重数据推测第2反应的化学方程式为 ;观察曲线说明氧气存在时有利于第2步反应进行,原因是 。
(3)第3步反应中释放的气体产物是 。观察曲线可判断出,氧气存在时不利于第3步反应进行,可能原因是 。

略

练习册系列答案
相关题目





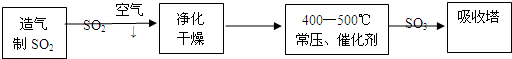
 SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。