题目内容
| A、向水中加入稀氨水,平衡正向移动 | B、将纯水加热,Kw增大,呈酸性 | C、向水中加入少量固体CH3COONa,平衡逆向移动 | D、向水中加入少量稀硫酸,Kw不变 |
B、根据纯水中氢离子浓度与氢氧根离子浓度相等判断;
C、根据醋酸钠中醋酸根离子结合水电离的氢离子分析;
D、根据加入稀硫酸后溶液的温度不变判断.
B、水的电离是吸热反应,升高温度,水的电离程度增大,水的离子积增大,但是溶液中氢离子与氢氧根离子浓度增大,溶液显示中性,故B错误;
C、向水中加入少量固体CH3COONa,醋酸根离子结合水电离的氢离子,促进了水的电离,水的电离平衡向着正向移动,故C错误;
D、加入稀硫酸,溶液中氢离子浓度增大,抑制了水的电离,但是由于温度不变,水的离子积不变,故D正确;
故选D.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
| |||||||||||||||||||||||||||
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。请回答相关问题:
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如下图,此过程的总方程式为 。
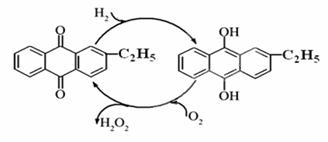
(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式 .
ii.测定H2O2水溶液pH的方法为(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 0.1gMnO2粉末 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
i.实验①和②的目的是_______。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2较稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_________。
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。
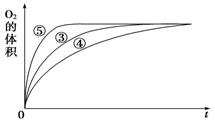
分析该图能够得出的实验结论是____________。
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:
MnO4-+H2O2+H+ —Mn2++H2O+ O2↑
i.请配平以上离子方程式
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000 mol·L-1的KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为 mol·L-1。
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果 (“偏高”或“偏低”或“不变”)。
 HSO3-
+ H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh=
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-
+ H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh=
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液, 的值
;加入少量水,水的电离程度将 。
的值
;加入少量水,水的电离程度将 。