题目内容
13. 在常温下,某水溶液M中.
在常温下,某水溶液M中.(1)若M中存在的离子只有:Na$_{\;}^+$、CH3COO-、H$_{\;}^+$、OH-,下列关系合理的是①②④.
①c(Na$_{\;}^+$)>c(CH3COO-)>c(OH-)>c(H$_{\;}^+$)
②c(Na$_{\;}^+$)>c(OH-)>c(CH3COO-)>c(H$_{\;}^+$)
③c(H$_{\;}^+$)>c(OH-)>c(Na$_{\;}^+$)>c(CH3COO-)
④c(Na$_{\;}^+$)=c(CH3COO-)且c(OH-)=c(H$_{\;}^+$)
(2)若M由两种相同物质的量浓度的溶液混合而成,其中只存在OH-、H$_{\;}^+$、NH$_4^+$、Cl-四种离子,且c(NH$_4^+$)>c(Cl-)>c(OH-)>c(H$_{\;}^+$),这两种溶液的溶质是NH4Cl和NH3(或NH4Cl和NH3•H2O).
(3)若M为0.01mol/L的氨水,向其中加入等体积pH=2的盐酸(忽略溶液体积变化),所得混合液中:c(NH$_4^+$)+c(H$_{\;}^+$)-c(OH-)=0.005mol/L.
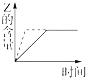
(4)若M为20mL稀硫酸和盐酸的混合液,向该混合酸溶液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=7(忽略溶液体积变化),试计算:
①最初混合酸溶液中c(H2SO4)=0.05mol/L;c(HCl)=0.20mol/L.
②B点溶液的pH=1.48(精确到0.01;可能用到的数据:1g2=0.30、1g3=0.48).
分析 (1)含有Na+、CH3COO-、H+、OH-,的溶液可能为醋酸钠溶液、可能为醋酸钠和醋酸的混合液、可能为醋酸钠和氢氧化钠的混合液;
(2)M由两种相同物质的量浓度的溶液混合而成,其中只存在OH-、H+、NH4+、Cl-四种离子,溶液可能为氯化铵和氨水或氯化铵和盐酸,c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液为碱性,以此来分析;
(3)溶质为氯化铵,由电荷守恒来分析;
(4)①据Ba(OH)2+H2SO4═BaSO4↓+2H2O计算硫酸的物质的量浓度,再利用H++OH-═H2O来计算盐酸的物质的量浓度;
②B点是反应滴入氢氧化钡溶液40ml,依据原溶液中氢离子知道了和滴入氢氧根离子物质的量计算得到剩余氢离子物质的量计算氢离子浓度,得到溶液PH.
解答 解:(1)①若溶液的溶质质量醋酸钠,由醋酸根离子水解显碱性可知,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故①正确;
②若溶液为醋酸钠和NaOH的混合物,溶液显碱性,且NaOH的物质的量远大于醋酸钠的物质的量时存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故②正确;
③若存在c(H+)>c(OH-)>c(Na+)>c(CH3COO-),不遵循电荷守恒,故③错误;
④若为醋酸钠和醋酸的混合液,溶液为中性,则c(Na+)=c(CH3COO-)且c(OH-)=c(H+),故④正确;
故答案为:①②④;
(2)M由两种相同物质的量浓度的溶液混合而成,其中只存在OH-、H+、NH4+、Cl-四种离子,溶液可能为氯化铵和氨水或氯化铵和盐酸,c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液NH4Cl和NH3(或NH4Cl和NH3•H2O),故答案为:NH4Cl和NH3(或NH4Cl和NH3•H2O);
(3)M为0.01mol/L的氨水,向其中加入等体积pH=2的盐酸溶液生成0.005mol/LNH4Cl溶液,则由电荷守恒可知c(NH4+)+c(H+)-c(OH-)=c(Cl-)=0.005mol/L,
故答案为:0.005mol/L;
(4)①由Ba(OH)2+H2SO4═BaSO4↓+2H2O,
1 1 1
x 0.001mol
则c(H2SO4)=$\frac{0.001mol}{0.02L}$=0.05 mol/L,
加入60mL Ba(OH)2溶液时,溶液的pH=7,设盐酸的浓度为y,则
0.06L×0.05mol/L×2=0.02L×0.05 mol/L×2+0.02L×y,
解得y=0.2mol/L,即c(HCl)=0.20 mol/L,
故答案为:0.05mol/L;0.20mol/L.
②B点滴入氢氧化钡溶液体积为40ml,
依据H++OH-=H2O计算
n(OH-)=0.05mol/L×0.04L×2=0.004mol
n(H+)=0.05mol/L×2×0.02L+0.20mol/L×0.02L=0.006mol
B点溶液中c(H+)=$\frac{0.006mol-0.004mol}{(0.02+0.04)L}$=$\frac{0.1}{3}$mol/L,
pH=-lg$\frac{0.1}{3}$=1.48,
故答案为:1.48.
点评 本题考查离子浓度大小的比较、水解、电离及有关化学反应方程式的计算,综合性较强,难度较大,注重对常考考点的考查.

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | ${\;}_{12}^{24}$Mg和${\;}_{12}^{26}$Mg互为同位素 | B. | 氯原子的结构示意图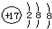 | ||
| C. | 氯化钠的电子式是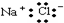 | D. | 乙酸与乙醇互为同分异构体 |
| A. | 将12.00g胆矾配成500mL溶液 | |
| B. | 将12.50g胆矾溶于少量水中,再用水稀释至500mL | |
| C. | 称取7.68g硫酸铜,加入500mL水 | |
| D. | 在80mL0.6mol/L CuSO4溶液中加入400mL水 |
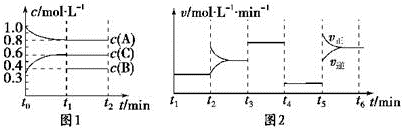
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c (B)未画出.
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=0.02mol•L-1•min-1.
(2)(2)t4-t5阶段改变的条件为减小压强,B的起始物质的量为1.0mol.各阶段平衡时对应的平衡常如表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g);△H=+200a kJ•mol-1.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4且b+$\frac{1}{3}$c=1.2.
 天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.(1)以甲烷为主要原料可以生成合成气(CO和H2),主要反应如下:有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
②CO(g)+H2O(g)═H2(g)+CO2(g);△H=-41.2kJ•mol-1
③2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ•mol-1
则反应CH4(g)+CO2(g)═2CO(g)+2H2(g)的△H=+247.3kJ/mol.
(2)CH4也可以和H2O(g)在催化剂表面反应生成合成气:CH4(g)+H2O(g)═3H2(g)+CO(g),该反应在不同温度下的化学平衡常数K如下表:
| 温度(℃) | 800 | 1000 | 1200 | 1400 |
| 平衡常数(K) | 0.45 | 1.92 | 276.5 | 1771.5 |
(2)已知800℃时,向1L密闭容器中投入0.5molCH4、0.5mol H2O、0.5molH2和0.5molCO,则平衡时向正向移动(选填“正向移动”、“逆向移动”或“不移动”.
(3)工业上利用合成气在恒容、催化剂和加热的条件下可以生产甲醇,其热化学方程式为:2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ/mol.
①以下各项能说明该反应达到平衡状态的是AB.
A、混合气体的平均式量保持不变
B、混合气体的压强不变
C、混合气体的密度保持不变
D、2v逆(H2)=v正(CH3OH)
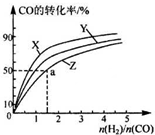
②在200℃、230℃和260℃三种不同温度、2L恒容密闭容器中研究合成甲醇的规律,如图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是260℃.由起始达到 a 点所需时间为 5min,则 H2的反应速率 为0.1mol/(L•min).
(4)以熔融Li2CO3和K2CO3为电解质,向一极通入甲烷,另一极通入空气和CO2,甲烷可形成燃料电池.负极的电极反应式为CH4-8e-+4CO32-=5CO2+2H2O,若该装置的电流强度为1.6A,理论上每分钟应向负极通入标准状况下的气体约为2.8mL.(已知:一个电子所带电量为1.6×10-19C)
| A. | Fe2(SO4)3 | B. | 稀硫酸 | C. | AgNO3溶液 | D. | CuSO4 溶液 |

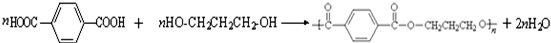 .
. ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.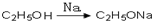 、
、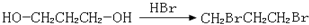 、
、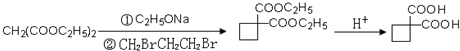 .
.