题目内容
(5分)现有A、B、C、D四种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)写出C. D 的名称:C ;
(2)A在周期表中的位置
(3)写出B2A3与氢氧化钠溶液反应的离子方程式 。
(4)比较B、C二种元素形成的简单离子半径的大小(用离子符号表示):
离子半径:
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)写出C. D 的名称:C ;
(2)A在周期表中的位置
(3)写出B2A3与氢氧化钠溶液反应的离子方程式 。
(4)比较B、C二种元素形成的简单离子半径的大小(用离子符号表示):
离子半径:
(每空1分)(1)C钾 D 碘(2)第二周期 第VIA族
(3)Al2O3+2OH-=2AlO2-+H2O (4)离子半径:K+>Al3+
(3)Al2O3+2OH-=2AlO2-+H2O (4)离子半径:K+>Al3+
根据①可知,A是O。根据②可知B是Al,化合物是氧化铝。根据③可知C是K。根据④⑤可知D是I。由于钾离子原子核外有3个电子层,而铝离子只有2个电子层,所以离子半径是K+>Al3+。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

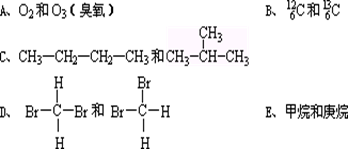
 恰好完全反应。B单质与D单质反应后可形成离子化合物
恰好完全反应。B单质与D单质反应后可形成离子化合物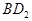 ;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。 的化学键类型是: .
的化学键类型是: .