题目内容
15.在一定条件下发生反应3A(g)+2B(g)═zC(g)+2D(g),在2L 的密闭容器中把 4mol A 和 2mol B 混合,2min 后反应达到平衡时生成 1.6mol C,又测得反应速率v(D)=0.2mol•(L•min)-1.则下列说法不正确的是( )| A. | z=4 | B. | B 的转化率是40% | ||
| C. | A 的平衡浓度是1.4 mol•L-1 | D. | 平衡时气体压强是原来压强的0.9 |
分析 根据反应速率之比等于化学计量数之比来确定化学计量数z,VD=0.2mol/(L•min),VC=$\frac{\frac{1.6mol}{2L}}{2min}$=0.4mol/(L•min),则z=4;
3A(g)+2B(g)?4C(g)+2D(g),
开始 4 2 0 0
转化 1.2 0.8 1.6 0.8
平衡 2.8 1.2 1.6 0.8
结合转化率的概念及物质的量之比等于压强之比来计算.
解答 解:根据反应速率之比等于化学计量数之比来确定化学计量数z,VD=0.2mol/(L•min),VC=$\frac{\frac{1.6mol}{2L}}{2min}$=0.4mol/(L•min),则z=4;
3A(g)+2B(g)?4C(g)+2D(g),
开始 4 2 0 0
转化 1.2 0.8 1.6 0.8
平衡 2.8 1.2 1.6 0.8
A、计算可知z=4,故A正确;
B、B的转化率=$\frac{0.8mol}{2mol}$×100%=40%,故B正确;
C、A的平衡浓度=$\frac{2.8mol}{2L}$=1.4mol/L,故C正确;
D、气体物质的量之比等于压强之比,平衡时气体压强是原来的$\frac{2.8mol+1.2mol+1.6mol+0.8mol}{4mol+2mol}$=$\frac{16}{15}$,故D错误;
故选D.
点评 本题考查化学平衡的计算,熟悉化学平衡的三段法计算及转化率的计算即可解答,注意反应速率与化学计量数的关系、化学计量数与压强的关系来解答,题目难度中等.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| 选项 | ①中的物质 | ②中的物质 | ③中的物质 | ③中的现象 |  |
| A | 浓氨水 | NaOH | AlCl3溶液 | 先产生白色沉淀,后沉淀溶解 | |
| B | 浓盐酸 | MnO2 | KI溶液 | 溶液变蓝色 | |
| C | 浓硫酸 | Na2SO3 | Ba(NO3)2溶液 | 无沉淀生成 | |
| D | 浓硝酸 | Cu | 含酚酞的NaOH溶液 | 溶液红色褪去 |
| A. | A | B. | B | C. | C | D. | D |
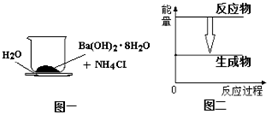 用玻璃棒迅速搅拌如图所示装置内(小烧杯与玻璃片之间有一薄层水)的固体混合物.稍后手拿起烧杯时发现玻璃片与烧杯粘结在一起.下列有关该反应的说法中正确的是( )
用玻璃棒迅速搅拌如图所示装置内(小烧杯与玻璃片之间有一薄层水)的固体混合物.稍后手拿起烧杯时发现玻璃片与烧杯粘结在一起.下列有关该反应的说法中正确的是( )| A. | 反应中有化学能转化为热能 | B. | 反应中的能量关系如图二 | ||
| C. | 是吸热反应 | D. | 化学键的总键能:反应物<生成物 |

