题目内容
12.下列说法正确的是( )| A. | 由水电离出的c(H+)═1×10-13mol/L的溶液中,CO32-、K+、SO42-、Cl-在溶液中可能大量存在 | |
| B. | 25℃、101kPa下,1 g氢气燃烧生成液态水放出142.9 kJ热量,其热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ•mol-1 | |
| C. | 浓度均为0.lmol•L-1Na2CO3和NaHCO3混合液中:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有14mol电子发生转移 |
分析 A.由水电离出的c(H+)═1×10-13mol/L的溶液,可能呈酸性或碱性;
B.根据物质的物质的量与反应热成正比,计算1mol氢气燃烧生成液态水放热,结合热化学方程式的书写要求,标注物质聚集状态和对应反应的焓变得到;
C.根据物料守恒判断;
D.14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由-1价降低为-2价,S元素的化合价由-1价升高为+6价.
解答 解:A..由水电离出的c(H+)═1×10-13mol/L的溶液,可能呈酸性或碱性,碱性条件下可大量共存,故A正确;
B.1gH2燃烧生成液态水时放出142.9kJ的热量,△H<0,1mol氢气燃烧生成液态水放热285.8 kJ,热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1,故B错误;
C.浓度均为0.lmol•L-1Na2CO3和NaHCO3混合液中:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故C错误;
D.5molFeS2发生反应,生成7molCu2S时,由S元素的化合价升高可知,有3mol×[6-(-1)]=21mol e-转移,故D错误.
故选A.
点评 本题考查了热化学方程式书写、溶液中离子浓度存在的物料守恒,影响水电离因素判断等知识,题目难度中等,注意掌握氧化还原反应电子转移的计算方法,学会利用电荷守恒、物料守恒、盐的水解原理结合溶液中的电离平衡的解决方法问题.

练习册系列答案
相关题目
3.某溶液中可能存在Br-、CO2-3、SO2-3、Al3+、I-、Mg2+、Na+等七种离子中的几种.现取该溶液进行实验,有如下实验现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色无味气体产生
②向所得橙色溶液中滴加足量BaCl2溶液,无沉淀生成
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色
据此可以推断,该溶液中肯定不存在的离子是( )
①向溶液中滴加足量氯水后,溶液变橙色,且有无色无味气体产生
②向所得橙色溶液中滴加足量BaCl2溶液,无沉淀生成
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色
据此可以推断,该溶液中肯定不存在的离子是( )
| A. | Mg2+、Na+、CO2-3、I- | B. | Al3+、Mg2+、SO32-、I- | ||
| C. | Al3+、Na+、SO2-3、I- | D. | Al3+、CO2-3、Br-、SO2-3 |
7.下列离子能大量共存的是( )
| A. | 无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、AlO2- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量AlO2-的溶液中:Mg2+、Al3+、SO42-、Cl- | |
| D. | 紫色石蕊试液呈红色的溶液中:Ca2+、K+、CO32-、NO3- |
4.下列仪器不能直接加热的是( )
| A. | 蒸发皿 | B. | 试管 | C. | 蒸馏烧瓶 | D. | 坩埚 |
1.为了火车客运安全,下列药品:①NH4NO3 ②(NH4)2SO4 ③食盐 ④油漆 ⑤汽油 ⑥黑火药 ⑦生石灰,从化学性质判断,由于易燃易爆而不能带上火车的是( )
| A. | ③④⑤⑥⑦ | B. | ①②⑦ | C. | ①④⑤⑥ | D. | ①④⑦ |
2.下列关于溶液的酸碱性说法正确的是( )
| A. | pH=7的溶液一定是中性 | |
| B. | 若某盐溶液呈酸性或碱性,一定是由于该盐发生了水解反应 | |
| C. | c(H+)<c(OH-)的溶液一定呈碱性 | |
| D. | 在100℃时,纯水的pH<7,因此显酸性 |
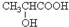 ,
,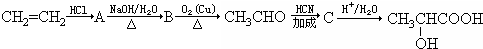
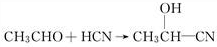 .A→B的反应类型为水解反应或取代反应.
.A→B的反应类型为水解反应或取代反应.


