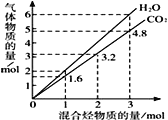
题目内容
【题目】下列过程仅涉及物理变化的是:
A. 硬水软化 B. 制蒸馏水 C. 粗盐的提纯 D. 用明矾净水
【答案】B
【解析】A、硬水是指含有较多钙镁离子的水,通过加热煮沸或加入某些试剂的方法使钙镁离子沉淀下来的方法叫作硬水的软化,发生了化学变化,A错误;B、制蒸馏水时,水由液态变为气态,只有物理变化,B正确;C、粗盐的提纯中加入NaOH、Na2CO3、BaCl2等试剂,使粗盐中的镁离子、钙离子和硫酸根离子转化为沉淀,发生了化学变化,C错误;D、明矾中的Al3+发生水解反应生成Fe(OH)3胶体,发生化学反应,D错误。正确答案为B。

【题目】利用下图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):__________________________。
(2)倒入NaOH溶液的正确操作是:______。(从下列选项中选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是__________;反应需要测量温度,每次测量温度后都必须__________;

(4)实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差 (t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 26.2 | 26.0 | 29.5 | |
2 | 27.0 | 27.4 | 32.3 | |
3 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 29.8 | |
①近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=______(取小数点后一位).
②上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)____.
a.实验装置保温、隔热效果差
b.用温度计测定H2SO4溶液起始温度后直接测定NaOH溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中. d.仰视量取酸碱溶液
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___;(填“偏大”、“偏小”或“无影响”)原因是________________________________。
【题目】在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
实验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A. 0.152 mol·L-1·s-1 B. 0.038 0 mol·L-1·s-1
C. 0.608 mol·L-1·s-1 D. 0.760 mol·L-1·s-1