题目内容
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中Z的核电荷数是Y的2倍。下列判断不正确的是
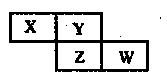

| A.最简单气态氢化物的热稳定性:Y>Z |
| B.最高价氧化物的水化物的酸性:X<W |
| C.X元素的氢化物与其最高价氧化物的水化物能形成离子化合物 |
| D.Y的氢化物沸点远高于Z的氢化物,是因为H-Y键的键能高于H-Z键的键能 |
D
试题分析:短周期元素中Z的核电荷数是Y的2倍,而且二者是同一主族的元素,则二者的原子序数相差8,则Y为O;Z为S;X为N;。W为Cl。A.同一主族的元素,从上到下,元素的非金属性逐渐减弱。元素的非金属性越弱,其氢化物的稳定性就越差。非金属性O>S。所以最简单气态氢化物的热稳定性:H2O>H2S。正确。B.HNO3、HClO4都是强酸,但是HClO4是已知酸中最强的一种酸。所以酸性最高价氧化物的水化物的酸性:HNO3<HClO4。正确。C.NH3与HNO3可形成盐NH4NO3。该盐是离子化合物。正确。D. H2O、H2S都是由分子构成的物质。分子间作用力越大,物质的熔点、沸点就越高。结构相似的物质,相对分子质量越大,。熔点、沸点就越高。沸点H2O>H2S,是因为在水的分子之间除了存在分子间作用力外,还存在氢键,增加了分子之间的相互作用。使物质融化或汽化需要消耗的能量就越高。即物质的熔点、沸点就越高。这与分子内的化学键无关。错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

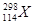 与
与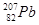 具有相同的最外层电子数
具有相同的最外层电子数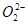 与S2-具有相同的质子数和电子数
与S2-具有相同的质子数和电子数