��Ŀ����
������Ԫ��A��B��C��Dԭ����������������ֻ��CΪ����Ԫ�أ�A��Cλ��ͬһ���壬B������������Ϊ������3����B��C��������������֮����D��������������ȣ���ش��������⣺��1��D������������Ӧˮ��������Ϊ______��
��2��C2B2�ĵ���ʽΪ______�����к��еĻ�ѧ������Ϊ______��
��3������������Ԫ���е��������ij���Σ�ˮ��Һ�Լ��ԣ��Ǽ�������������Ҫ�ɷ֣���������Һ����KI������Һ�У���Һ��Ϊ��ɫ����Ӧ���ӷ���ʽΪ______
��4����ʯī�缫���CD�ı�����Һ����Ӧ�����ӷ���ʽΪ______ Cl2��+H2��+2NaOH
���𰸡�������������Ԫ�� A��B��C��D ԭ����������������ֻ��CΪ����Ԫ�أ� B�������������Ǵ�����3������B��2�����Ӳ㣬����������Ϊ6����BΪ��Ԫ�أ���ֻ�� C Ϊ����Ԫ�أ�ԭ������������Ԫ�أ���CΪ�ƻ�þ������B��C ������������֮���� D ��������������ȣ���C��������������2��A��C λ��ͬһ���壬��A��C λ�ڢ�A�壬��AΪ��Ԫ�أ�CΪ��Ԫ�أ�Dԭ������������Ϊ1+6=7����DΪ��Ԫ�أ��ݴ˽��
����⣺������Ԫ�� A��B��C��D ԭ����������������ֻ��CΪ����Ԫ�أ� B�������������Ǵ�����3������B��2�����Ӳ㣬����������Ϊ6����BΪ��Ԫ�أ���ֻ�� C Ϊ����Ԫ�أ�ԭ������������Ԫ�أ���CΪ�ƻ�þ������B��C ������������֮���� D ��������������ȣ���C��������������2��A��C λ��ͬһ���壬��A��C λ�ڢ�A�壬��AΪ��Ԫ�أ�CΪ��Ԫ�أ�Dԭ������������Ϊ1+6=7����DΪ��Ԫ�أ�
��1��DΪ��Ԫ�أ���Ԫ�ص�����������Ӧˮ�����Ǹ����ᣬ�ʴ�Ϊ�������
��2��BΪ��Ԫ�أ�CΪ��Ԫ�أ�C2B2ΪNa2O2��������������������ӹ��ɣ�����ʽΪ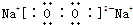 �����������������������֮��Ϊ���Ӽ�����������������ԭ��֮��Ϊ�Ǽ��Լ����ʴ�Ϊ��
�����������������������֮��Ϊ���Ӽ�����������������ԭ��֮��Ϊ�Ǽ��Լ����ʴ�Ϊ��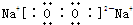 �����Ӽ����Ǽ��Լ���
�����Ӽ����Ǽ��Լ���
��3������������Ԫ���е��������ij���Σ�ˮ��Һ�Լ��ԣ��Ǽ�������������Ҫ�ɷ֣�����ΪNaClO����NaClO��Һ����KI������Һ�У���Һ��Ϊ��ɫ��˵�����ɵⵥ�ʣ������������ԭ���������ӣ���Ӧ���ӷ���ʽΪ2I-+ClO-+H2O=I2+Cl-+2OH-��
�ʴ�Ϊ��2I-+ClO-+H2O=I2+Cl-+2OH-��
��4����ʯī�缫���NaCl�ı�����Һ����Ӧ�Ļ�ѧ����ʽΪ 2NaCl+2H2O Cl2��+H2��+2NaOH��
Cl2��+H2��+2NaOH��
����Ӧ����Һ�����Ϊ 200mL����� pHΪ13����c��OH-��=0.1mol/L������n��NaOH��=0.2L×0.1mol/L=0.02mol����������������Ӧ���������ɵ�����Ϊ�������ɷ���ʽ��֪n��Cl2��= n��NaOH��=0.01mol������Ϊ0.01mol×71g/mol=0.71g��
n��NaOH��=0.01mol������Ϊ0.01mol×71g/mol=0.71g��
���ݵ���ת���غ��֪�����·��ͨ�����ӵ����ʵ���Ϊ0.01mol×2=0.02mol��
�ʴ�Ϊ��2NaCl+2H2O Cl2��+H2��+2NaOH��0.71g��0.02mol��
Cl2��+H2��+2NaOH��0.71g��0.02mol��
��4��ʵ����������NaCl��Һ�������� Cl-����������������Ϊ��ȡ������Һ�������м��������ữ����������Һ�����а�ɫ������������֤����Cl-��
�ʴ�Ϊ��ȡ������Һ�������м��������ữ����������Һ�����а�ɫ������������֤����Cl-��
���������⿼��ṹ������λ�ù�ϵ������ʽ�����ԭ�������㡢ʵ�鷽����Ƶȣ��Ѷ��еȣ��ƶ�Ԫ���ǽ���ؼ�����BԪ��Ϊͻ�ƿڣ��ۺϷ���Ԫ��������ԭ��������������������ϵ�����ƶϣ�
����⣺������Ԫ�� A��B��C��D ԭ����������������ֻ��CΪ����Ԫ�أ� B�������������Ǵ�����3������B��2�����Ӳ㣬����������Ϊ6����BΪ��Ԫ�أ���ֻ�� C Ϊ����Ԫ�أ�ԭ������������Ԫ�أ���CΪ�ƻ�þ������B��C ������������֮���� D ��������������ȣ���C��������������2��A��C λ��ͬһ���壬��A��C λ�ڢ�A�壬��AΪ��Ԫ�أ�CΪ��Ԫ�أ�Dԭ������������Ϊ1+6=7����DΪ��Ԫ�أ�
��1��DΪ��Ԫ�أ���Ԫ�ص�����������Ӧˮ�����Ǹ����ᣬ�ʴ�Ϊ�������
��2��BΪ��Ԫ�أ�CΪ��Ԫ�أ�C2B2ΪNa2O2��������������������ӹ��ɣ�����ʽΪ
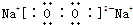 �����������������������֮��Ϊ���Ӽ�����������������ԭ��֮��Ϊ�Ǽ��Լ����ʴ�Ϊ��
�����������������������֮��Ϊ���Ӽ�����������������ԭ��֮��Ϊ�Ǽ��Լ����ʴ�Ϊ��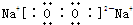 �����Ӽ����Ǽ��Լ���
�����Ӽ����Ǽ��Լ�����3������������Ԫ���е��������ij���Σ�ˮ��Һ�Լ��ԣ��Ǽ�������������Ҫ�ɷ֣�����ΪNaClO����NaClO��Һ����KI������Һ�У���Һ��Ϊ��ɫ��˵�����ɵⵥ�ʣ������������ԭ���������ӣ���Ӧ���ӷ���ʽΪ2I-+ClO-+H2O=I2+Cl-+2OH-��
�ʴ�Ϊ��2I-+ClO-+H2O=I2+Cl-+2OH-��
��4����ʯī�缫���NaCl�ı�����Һ����Ӧ�Ļ�ѧ����ʽΪ 2NaCl+2H2O
 Cl2��+H2��+2NaOH��
Cl2��+H2��+2NaOH������Ӧ����Һ�����Ϊ 200mL����� pHΪ13����c��OH-��=0.1mol/L������n��NaOH��=0.2L×0.1mol/L=0.02mol����������������Ӧ���������ɵ�����Ϊ�������ɷ���ʽ��֪n��Cl2��=
 n��NaOH��=0.01mol������Ϊ0.01mol×71g/mol=0.71g��
n��NaOH��=0.01mol������Ϊ0.01mol×71g/mol=0.71g�����ݵ���ת���غ��֪�����·��ͨ�����ӵ����ʵ���Ϊ0.01mol×2=0.02mol��
�ʴ�Ϊ��2NaCl+2H2O
 Cl2��+H2��+2NaOH��0.71g��0.02mol��
Cl2��+H2��+2NaOH��0.71g��0.02mol����4��ʵ����������NaCl��Һ�������� Cl-����������������Ϊ��ȡ������Һ�������м��������ữ����������Һ�����а�ɫ������������֤����Cl-��
�ʴ�Ϊ��ȡ������Һ�������м��������ữ����������Һ�����а�ɫ������������֤����Cl-��
���������⿼��ṹ������λ�ù�ϵ������ʽ�����ԭ�������㡢ʵ�鷽����Ƶȣ��Ѷ��еȣ��ƶ�Ԫ���ǽ���ؼ�����BԪ��Ϊͻ�ƿڣ��ۺϷ���Ԫ��������ԭ��������������������ϵ�����ƶϣ�

��ϰ��ϵ�д�
�����Ŀ



