题目内容
【题目】下图是氮元素在煤粉使用过程中的转化关系:

(1)③中加入的物质可以是___________(填标号)。
a.空气b.CO c.KNO3d.NH3
已知:N2(g) +O2(g)=2NO(g) △H = a kJ·mol-1
N2(g)+3H2(g)=2NH3(g) △H = b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H = c kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H = d kJ·mol-1
上面转化关系反应后恢复至常温常压,根据以上信息写出③中你所选物质参与反应的热化学方程
式___________(如果所选物质不只一种,则只要写出其中一个热化学方程式即可)。
(2)将烟气中的氮氧化物(NOx)转化为无害物质,这个过程称为脱硝。下面反应为处理方法之一:
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H = -1625.5kJ·mol-1
4N2(g)+6H2O(g)△H = -1625.5kJ·mol-1
①若反应生成1molN2,则反应中转移的电子数为___________mol。
②使上述反应速率增大且平衡向右移动的措施是___________。
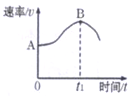
③氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如图所示,则X是___________(填化学式)。在体积为2L的容器中模拟进行上述反应,初始时加入8molNO和3.5molO2,氨氮比为0.5时,该反应的平衡常数K =___________(保留二位小数)。当n(NH3)/n(NO)>1.0 时,烟气中NO浓度反而增大,主要原因是___________(用化学方程式表示)。

④若上述反应在与外界绝热的容器中进行,氨氮比由0.5增加到1.0时,在此过程中该反应的平衡常数___________(填“增大”、“减小”或“不变”)。
【答案】 bd 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH= ( 3c-3a-2b) kJ·mol-1
[或2CO(g) +2NO(g)=2CO 2 (g)+N2(g) ΔH= ( d-a) kJ·mol-1] 3 增大反应物浓度 NH3 0.09 4NH3+5O2![]() 4NO+6H2O 减小
4NO+6H2O 减小
【解析】(1)氮元素化合价由+2价变成0价,得到电子,被还原,应加还原剂,CO和氨气,答案选bd;已知:N2(g) +O2(g)=2NO(g) △H = a kJ·mol-1 …①;N2(g)+3H2(g)=2NH3(g) △H = b kJ·mol-1…②;2H2(g)+O2(g)=2H2O(l) △H = c kJ·mol-1…③;根据盖斯定律可知3×③-3×①-2×②即得到反应4NH3(g)+6NO(g)=5N2(g)+6H2O(l)的△H=(3c-3a-2b)kJmol-1;(2)①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g),反应中氨气失电子做还原剂,一氧化氮和氧气得到电子做氧化剂,反应中生成4mol氮气电子转移总数为12mol,若反应生成1molN2,则反应中转移的电子数为3mol;②反应为气体体积增大的放热反应,增大反应物浓度增大反应速率,平衡正向进行,降低温度平衡正向进行,但反应速率减小,减小压强速率减小.平衡正向进行,所以使上述反应速率增大且平衡向右移动的措施是增大反应物浓度:增大反应物浓度;③氨氮比[n(NH3)/n(NO)]越大,则氨气的物质的量越大,氨气的转化率越小,由图可知,随着氨气的浓度的增大,X的转化率减小,所以X为NH3;在体积为2L的容器中模拟进行上述反应,初始时加入8molNO和3.5molO2,氨氮比为0.5时,氨气物质的量为0.5×8mol=4mol,氨气转化率为50%,则
4N2(g)+6H2O(g),反应中氨气失电子做还原剂,一氧化氮和氧气得到电子做氧化剂,反应中生成4mol氮气电子转移总数为12mol,若反应生成1molN2,则反应中转移的电子数为3mol;②反应为气体体积增大的放热反应,增大反应物浓度增大反应速率,平衡正向进行,降低温度平衡正向进行,但反应速率减小,减小压强速率减小.平衡正向进行,所以使上述反应速率增大且平衡向右移动的措施是增大反应物浓度:增大反应物浓度;③氨氮比[n(NH3)/n(NO)]越大,则氨气的物质的量越大,氨气的转化率越小,由图可知,随着氨气的浓度的增大,X的转化率减小,所以X为NH3;在体积为2L的容器中模拟进行上述反应,初始时加入8molNO和3.5molO2,氨氮比为0.5时,氨气物质的量为0.5×8mol=4mol,氨气转化率为50%,则
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
起始浓度(mol/L) 2 4 1.75 0 0
变化浓度(mol/L) 1 1 0.25 1 1.5
平衡浓度(mol/L) 1 3 1.5 1 1.5
K=1.56×14/(14×34×1.5)=0.09;当n(NH3)/n(NO)>1.0时,氨气与氧气的反应生成NO,所以烟气中NO浓度增大,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O;④若上述反应在与外界绝热的容器中进行,氨氮比增大,即氨气的浓度增大,平衡正向移动过程中放出热量,温度升高,会导致平衡逆向进行,所以氨氮比由0.5增加到1.0时,脱硝主要反应的平衡常数减小。
4NO+6H2O;④若上述反应在与外界绝热的容器中进行,氨氮比增大,即氨气的浓度增大,平衡正向移动过程中放出热量,温度升高,会导致平衡逆向进行,所以氨氮比由0.5增加到1.0时,脱硝主要反应的平衡常数减小。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案