��Ŀ����
����Ŀ����(Mo)��һ�ֹ��Ƚ���Ԫ�أ�ͨ�������Ͻ���ֵ����Ӽ��������ƾ��壨Na2MoO42H2O����һ����������ȴˮϵͳ�Ľ�����ʴ������ҵ�������⾫����Ҫ�ɷ��Dz�����ˮ��MoS2���Ʊ������Ƽ��Ʊ����������Ҫ����ͼ��ͼ��ʾ��

��1��Na2MoO4��2H2O����Ԫ�صĻ��ϼ���_______���ᾧ�õ��������ƾ���ʱ�ֲ�Ʒ��Ҫ�õ������������ƾ��壬��һ����Ҫ���еIJ�����___________�������ƣ���
��2�����չ������⾫��������Ҫ��Ӧ�Ļ�ѧ����ʽΪMoS2+O2![]() MoO3+SO2(δ��ƽ)���÷�Ӧ������������__________(�ѧʽ)������Ӧ������36.0gMoO3,��Ӧ��ת�Ƶ��ӵ���ĿΪ__________��
MoO3+SO2(δ��ƽ)���÷�Ӧ������������__________(�ѧʽ)������Ӧ������36.0gMoO3,��Ӧ��ת�Ƶ��ӵ���ĿΪ__________��
��3��β���к���SO2��Ҫ���������в����������ռ�����_______������ţ���
a.Ca(OH)2 b.HNO3 c.Na2CO3
��4������Na2CO3��Һʱ������Ӧ�Ļ�ѧ����ʽΪ_________������߸÷�Ӧ���ʵĴ�ʩ��______������ţ���
a.���ֲ�Ʒ���� b.����̼������Һ��Ũ�� c.�ʵ������¶�
��5���������ȷ�ӦҲ�ɻ��ս����⣬д��MoO3�������ȷ�Ӧ�Ļ�ѧ����ʽ___________��
��6����֪��������Һ��c(MoO42-)=0.40molL-1��c(CO32-)=0.52molL-1������������Һ�Ʊ������ƾ���ʱ�������Ba(OH)2�����Գ�ȥCO32-����BaMoO4��ʼ����ʱ��CO32-��ȥ����Ϊ______��[��֪��Ksp(BaCO3)=2.6��10��9��Ksp(BaMoO4)=4.0��10-8,������Һ������仯]
���𰸡� +6 �ؽᾧ MoO3��SO2 3.5NA b MoO3+Na2CO3=Na2MoO4+CO2�� ac 4Al+2MoO3![]() 2Mo+2Al2O3 95%
2Mo+2Al2O3 95%
����������1������ᾧˮ������������Ԫ�صĻ��ϼ�ֻ����Na2MoO4����Ԫ�صĻ��ϼۼ��ɣ���Ԫ����+1����Ԫ����-2������Ԫ�صĻ��ϼ���x�������ڻ��������������ϼ۴�����Ϊ�㣬��֪����������Ԫ�صĻ��ϼۣ���+1����2+x+��-2����4=0����x=+6���ᾧ�õ��������ƾ����Ǵֲ�Ʒ��Ҫ�õ������������ƾ��壬��һ����Ҫ���еIJ������ؽᾧ����2�����չ������⾫��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��2MoS2+7O2![]() 2MoO3+4SO2��Ԫ�ػ��ϼ����ߵ�ʧȥ���ӷ���������Ӧ�õ����������Ӧ��MoԪ�ػ��ϼ�+2�۱仯Ϊ+6�ۣ���Ԫ�ػ��ϼ�-1�۱仯Ϊ+4�ۣ��÷�Ӧ������������MoO3��SO2����Ӧ������2molMoO3����ת��28mol����Ӧ������36.0gMoO3����0.25molMoO3ʱת�Ƶ��ӵ����ʵ�����28mol/2��0.2��3.5mol����ĿΪ3.5NA����3��SO2����������������������ƻ�̼������Һ��Ӧ��Ҳ�ܱ����������������ɵ�����������Ⱦ��������ѡb����4�����������£�MoO3��Na2CO3��Һ��Ӧ���ɶ�����̼�������ƣ����ӷ���ʽΪMoO3+Na2CO3=Na2MoO4+CO2����a.���ֲ�Ʒ��������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�a��ȷ��b.����̼������Һ��Ũ�ȷ�Ӧ���ʼ�С��b����c.�ʵ������¶ȣ��ӿ췴Ӧ���ʣ�c��ȷ����ѡac����5��MoO3�������ȷ�Ӧ�Ļ�ѧ����ʽΪ4Al+2MoO3
2MoO3+4SO2��Ԫ�ػ��ϼ����ߵ�ʧȥ���ӷ���������Ӧ�õ����������Ӧ��MoԪ�ػ��ϼ�+2�۱仯Ϊ+6�ۣ���Ԫ�ػ��ϼ�-1�۱仯Ϊ+4�ۣ��÷�Ӧ������������MoO3��SO2����Ӧ������2molMoO3����ת��28mol����Ӧ������36.0gMoO3����0.25molMoO3ʱת�Ƶ��ӵ����ʵ�����28mol/2��0.2��3.5mol����ĿΪ3.5NA����3��SO2����������������������ƻ�̼������Һ��Ӧ��Ҳ�ܱ����������������ɵ�����������Ⱦ��������ѡb����4�����������£�MoO3��Na2CO3��Һ��Ӧ���ɶ�����̼�������ƣ����ӷ���ʽΪMoO3+Na2CO3=Na2MoO4+CO2����a.���ֲ�Ʒ��������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�a��ȷ��b.����̼������Һ��Ũ�ȷ�Ӧ���ʼ�С��b����c.�ʵ������¶ȣ��ӿ췴Ӧ���ʣ�c��ȷ����ѡac����5��MoO3�������ȷ�Ӧ�Ļ�ѧ����ʽΪ4Al+2MoO3![]() 2Mo+2Al2O3����6����BaMoO4��ʼ����ʱ��Һ�б�����Ũ��c��Ba2+��=Ksp(BaMnO4)/c(MnO4)=Ksp(BaMoO4)/0.4mol/L=1��10��7mol/L����Һ��̼�������Ũ��c��CO32-��=Ksp(BaCO3)/c(Ba2+)��2.6��10��2mol/L������CO32-��ȥ����Ϊ
2Mo+2Al2O3����6����BaMoO4��ʼ����ʱ��Һ�б�����Ũ��c��Ba2+��=Ksp(BaMnO4)/c(MnO4)=Ksp(BaMoO4)/0.4mol/L=1��10��7mol/L����Һ��̼�������Ũ��c��CO32-��=Ksp(BaCO3)/c(Ba2+)��2.6��10��2mol/L������CO32-��ȥ����Ϊ![]() 95%��
95%��

 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�����Ŀ��±��Ԫ�����������й㷺Ӧ�ã���������֪ʶ�ش��������⡣
��1����Ԫ�ػ�̬ԭ�ӵļ۵����Ų�ͼ��_________��±��Ԫ��λ��Ԫ�����ڱ�______����
��2����һ��Ũ�ȵ��������Һ�У����������Զ����ӵϣ�HF��2��ʽ���ڣ�ʹHF���ӵϵ���������_______________��
��3��BF3�����������壬��ǿ�ҵĽ��ܻ����ӶԵ�����BF3���ӵ����幹��Ϊ______����̬ʱ�ľ���������_______��BF3��NH3�����������ɰ�ɫ���壬д���ð�ɫ�������ʵĽṹʽ����ע�����е���λ��_____��
��4�������±��ṩ�������жϣ��۵���ߡ�Ӳ��������_______���ѧʽ����
���Ӿ��� | NaF | MgF2 | AlF3 |
�����ܣ�KJ��mol-1�� | 923 | 2957 | 5492 |
��5����֪NaClO2������������ΪV�ͣ�ClO2-����ԭ�ӵĻ����Ӷ�����______��ClO2-����ԭ�ӵ��ӻ��������Ϊ_____��HClO4��HClO2����ǿ��ԭ����_______��
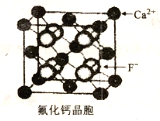
��6��CaF2��������ͼ��ʾ����֪��NAΪ����٤���������������ڵ�����Ca2+�ĺ˼��Ϊacm����CaF2���ܶȿɱ�ʾΪ_____g��cm-3��