题目内容
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室利用SO2(g)和Cl2(g)合成硫酰氯的实验装置如下图所示(夹持装置已省略):

己知:①SO2(g)+Cl2(g)![]() SO2Cl2(I) ΔH=-97kJ/mol;
SO2Cl2(I) ΔH=-97kJ/mol;
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气
回答下列问题:
(1)装置H的名称是_______________,装置E中活性炭的作用是 _____________。
(2)请指出下列装置中应盛入的试剂:B_____________、F________________。
(3)若采用实验室制法制取Cl2,其发生装置应选择_________装置 (用A、B、C等编号填空〉,其中发生反应的离子方程式为____________________。
(4)为什么硫酰氯在潮湿空气中易“发烟”____________ (结合化学方程式说明)。
(5)为了使通入反应器的SO2和Cl2达到最佳反应比例,可观察_________(填现象)来反映通入气体的速率,利用反应液的滴加快慢对气体通入速率加以控制。
(6)该装置尚存在明显的缺陷,请指出_____________________。
【答案】 冷凝管 利用活性炭对气体的吸附作用,提供反应载体 饱和食盐水 浓硫酸 A MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O SO2Cl2 +2H2O === H2SO4+2HCl,HCl结合水蒸汽形成白雾 装置C和F中产生气泡的快慢 末端没有尾气处理装置和干燥装置,污染大、外界水蒸汽易进行装置内
Mn2++Cl2↑+2H2O SO2Cl2 +2H2O === H2SO4+2HCl,HCl结合水蒸汽形成白雾 装置C和F中产生气泡的快慢 末端没有尾气处理装置和干燥装置,污染大、外界水蒸汽易进行装置内
【解析】根据装置图可知,装置A用于提供氯气,B、C为除杂装置,G为生成二氧化硫的装置,硫酰氯易水解,因此氯气与二氧化硫需干燥,干燥氯气与二氧化硫的反应需要用活性碳作催化剂,硫酰氯易水解易挥发,所以在三颈烧瓶上方应连接一个冷凝管和装有碱石灰的干燥管。
(1)根据装置图,装置H是冷凝管,装置E中活性炭具有吸附性,可以提供反应的载体,作催化剂,故答案为:冷凝管 (2). 利用活性炭对气体的吸附作用,提供反应载体(或催化剂);
(2) B、C为除去氯气中的氯化氢和水蒸气,因此B装置中应该盛放饱和食盐水,C中盛放浓硫酸,F为干燥二氧化硫的装置,可以选用浓硫酸,故答案为:饱和食盐水;浓硫酸;
(3)根据上述分析,若采用实验室制法制取Cl2,其发生装置应选择A装置,其中发生反应的离子方程式为MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O,故答案为:A;MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O,故答案为:A;MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4) SO2Cl2 +2H2O = H2SO4+2HCl,HCl结合水蒸汽形成白雾,造成硫酰氯在潮湿空气中易“发烟”,故答案为:SO2Cl2 +2H2O = H2SO4+2HCl,HCl结合水蒸汽形成白雾;
(5)为了使通入反应器的SO2和Cl2达到最佳反应比例,可观察装置C和F中产生气泡的快慢来反映通入气体的速率,故答案为:装置C和F中产生气泡的快慢;
(6)氯气和二氧化硫均能够污染空气,该装置中末端没有尾气处理装置和干燥装置,污染大、外界水蒸汽也易进行装置E内,故答案为:末端没有尾气处理装置和干燥装置,污染大、外界水蒸汽易进行装置内。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。

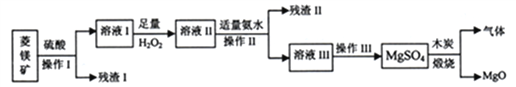
【题目】以菱镁矿(主要成分为MgCO3、含少量FeCO3、SiO2)制备高纯氧化镁的流程如下图所示:
己知:25℃时,指示剂变色pH范围和几种氢氧化物的ksp及pH的关系如下表:
指示剂 | 酚酞 | 甲基酸 |
变色范围(pH) | 8.2-10.0 | 3.1-4.4 |
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀时pH | 1.1 | 5.9 | 8.4 |
沉淀完全时pH | 3.7 | 9.6 | 10.2 |
溶度积常数 | 4×10-34 | 8×10-16 | 2×10-13 |
(1)操作II和III中涉及的分离方法分别是____________、_______________。
(2)残渣I的主要成分是____________,加入H2O2的过程中可观察到的现象是___________,其中发生的离子反应方程式是_________________________。
(3)MgSO4和木炭在800℃煅烧时,只生成MgO和两种气体,将混合气体通入NaOH溶液时,气体被完全吸收。煅烧时发生反应的化学方程式是_____________。
(4)采用滴定法测定溶液II与加入氨水的最佳体积比,可以减少氨水的消粍和Mg2+的损失。实验中应选取_______________指示剂,加入氨水是为了沉淀溶液II中的___________离子,若终点时该离子浓度=1.0×10-5mol·L-1,则溶液III的pH=_____________(己知:lg2=0.3)。