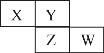题目内容
【题目】下列说法中正确的是( )
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 molL﹣1氨水中加入少量水,pH减小, ![]() 减小
减小
【答案】A
【解析】解:A、纯水电离是吸热反应,加热促进电离,Kw增大,PH减小,故A正确;
B、保存FeSO4溶液时,加入稀HNO3氧化亚铁离子,不能抑制Fe2+水解,故B错误;
C、FeCl3溶液蒸干、灼烧至恒重,蒸干过程中氯化氢挥发,促进水解生成氢氧化铁沉淀分解生成氧化铁,故C错误;
D、向0.1 molL﹣1 氨水中加入少量水,氨水加水稀释促进电离氢氧根离子浓度减小,溶液PH减小,氢氧根离子浓度和氨水浓度比值增大,故D错误;
故选A.

【题目】[化学一一选修3:物质结构与性质]碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是__________,该能级的电子云轮廓图为______________。金属Ge晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于__________晶体。
(2)①(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为______________,(CH3)3C+中碳骨架的几何构型为____________________。
②治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______(填标号)
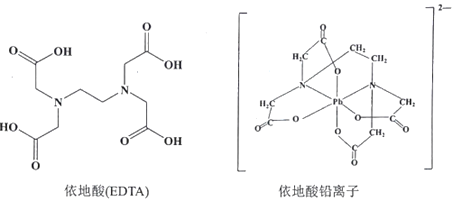
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(3)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________________________。
(4)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
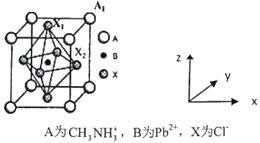
①若该晶胞的边长为anm,则Cl-间的最短距离是____________________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于_________位置。原子坐标参数B为(0,0,0);A1为(1/2,1/2,1/2),则X2为_________________。