题目内容
【题目】下列有关说法中正确的是
A. 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN)
B. 由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C. 已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
【答案】A
【解析】试题分析:A.25℃时NH4CN水溶液显碱性,说明CN-的水解程度大于NH4+的水解程度,则HCN电离程度小于NH3H2O电离程度,因此25℃时的电离常数K(NH3H2O)>K(HCN),A正确;B.由水电离出的c(H+)=10-12molL-1的溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子均反应,在溶液中一定不能大量共存,B错误;C.析出沉淀时,AgCl溶液中c(Ag+)=![]() =
=![]() mol/L=1.56×10-8mol/L,Ag2CrO4溶液中c(Ag+)=
mol/L=1.56×10-8mol/L,Ag2CrO4溶液中c(Ag+)=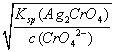 =
=![]() mol/L=3×10-5,c(Ag+)越小,则越先生成沉淀,所以2种阴离子产生沉淀的先后顺序为Cl-、CrO42-,C错误;D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-),D错误,答案选A。
mol/L=3×10-5,c(Ag+)越小,则越先生成沉淀,所以2种阴离子产生沉淀的先后顺序为Cl-、CrO42-,C错误;D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-),D错误,答案选A。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目