题目内容
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图,下列判断正确的是( )
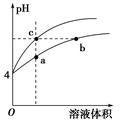

| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
| D.a、b、c三点溶液水的电离程度a>b>c |
D
pH=4的HCl溶液和NH4Cl溶液,在稀释过程中,因平衡NH4++H2O NH3·H2O+H+,正向移动,所以氯化铵溶液pH变化程度比盐酸pH变化程度小,故下方曲线为NH4Cl溶液。从图可知,a点溶液离子浓度大于c点,故导电能力a>c,A项错误;根据质子守恒,b点时溶液关系为c(H+)=c(NH3·H2O)+c(OH-),B项错误;b点为NH4+水解导致溶液呈酸性,b点溶液中NH4+和H+均消耗NaOH,故Vb>Vc,C项错误;NH4Cl溶液中NH4+水解,促进水的电离,a点溶液的pH小于b点,故溶液中水电离的H+浓度a点大于b点,c点是盐酸,抑制水的电离,故水的电离程度a>b>c,D项正确。
NH3·H2O+H+,正向移动,所以氯化铵溶液pH变化程度比盐酸pH变化程度小,故下方曲线为NH4Cl溶液。从图可知,a点溶液离子浓度大于c点,故导电能力a>c,A项错误;根据质子守恒,b点时溶液关系为c(H+)=c(NH3·H2O)+c(OH-),B项错误;b点为NH4+水解导致溶液呈酸性,b点溶液中NH4+和H+均消耗NaOH,故Vb>Vc,C项错误;NH4Cl溶液中NH4+水解,促进水的电离,a点溶液的pH小于b点,故溶液中水电离的H+浓度a点大于b点,c点是盐酸,抑制水的电离,故水的电离程度a>b>c,D项正确。
 NH3·H2O+H+,正向移动,所以氯化铵溶液pH变化程度比盐酸pH变化程度小,故下方曲线为NH4Cl溶液。从图可知,a点溶液离子浓度大于c点,故导电能力a>c,A项错误;根据质子守恒,b点时溶液关系为c(H+)=c(NH3·H2O)+c(OH-),B项错误;b点为NH4+水解导致溶液呈酸性,b点溶液中NH4+和H+均消耗NaOH,故Vb>Vc,C项错误;NH4Cl溶液中NH4+水解,促进水的电离,a点溶液的pH小于b点,故溶液中水电离的H+浓度a点大于b点,c点是盐酸,抑制水的电离,故水的电离程度a>b>c,D项正确。
NH3·H2O+H+,正向移动,所以氯化铵溶液pH变化程度比盐酸pH变化程度小,故下方曲线为NH4Cl溶液。从图可知,a点溶液离子浓度大于c点,故导电能力a>c,A项错误;根据质子守恒,b点时溶液关系为c(H+)=c(NH3·H2O)+c(OH-),B项错误;b点为NH4+水解导致溶液呈酸性,b点溶液中NH4+和H+均消耗NaOH,故Vb>Vc,C项错误;NH4Cl溶液中NH4+水解,促进水的电离,a点溶液的pH小于b点,故溶液中水电离的H+浓度a点大于b点,c点是盐酸,抑制水的电离,故水的电离程度a>b>c,D项正确。
练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
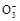
 H++C
H++C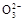
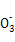 )+2c(R
)+2c(R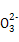 )
)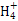 ):①<③<②
):①<③<②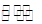 CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是