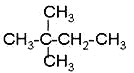
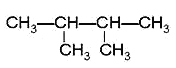题目内容
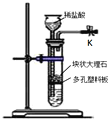
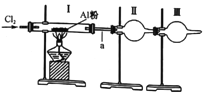
【题目】某学习小组做了如下实验探究海带中碘元素的存在形式,探究过程如图:

(1)操作I为灼烧,则灼烧时应该用___(仪器名称)盛装海带,操作II为___;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是___。
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
推测:①以IO![]() 形式存在②以I-形式存在
形式存在②以I-形式存在
查阅资料:IO![]() 具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
限选试剂:3%H2O2溶液、KSCN溶液、FeC12溶液、稀硫酸
序号 | 实验操作 | 实验现象 | 结论 |
① | 取少量稀释后的溶液A加入淀粉后再 用硫酸酸化,分装于试管I、II | 无现象 | |
② | 往试管I中加入FeC12溶液,然后加入2滴KSCN溶液并振荡; | ___ | 证明不是以IO |
③ | 往试管II中加入___; | ____ | 证明以I-形式存在 |
(4)取20mL稀释后溶液A于锥形瓶,滴加0.01mo1/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;已知在酸性条件下,MnO![]() 的还原产物为Mn2+,写出离子方程式___。
的还原产物为Mn2+,写出离子方程式___。
【答案】坩埚 过滤 加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液 无明显现象/不变红 3%H2O2溶液并振荡 变蓝 2MnO![]() +10I-+16H+=2Mn2++5I2+8H2O
+10I-+16H+=2Mn2++5I2+8H2O
【解析】
实验中,将干海带放入坩埚中灼烧得到固体粉末Ⅰ(海带灰),水浸后过滤得到固体B和溶液A,溶液A中含有碘元素,利用氧化还原反应的相关知识点进行探究碘元素的存在形式。
(1)干海带放入坩埚中灼烧得到固体粉末Ⅰ(海带灰),水浸后过滤得到固体B和溶液A,故答案为:坩埚;过滤;
(2)为了加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液,水浸时通常要将悬浊液煮沸2-3min,故答案为:加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液;
(3)若碘元素不是以IO![]() 形式存在时,则Fe2+不会被氧化成Fe3+,加入KSCN溶液后无明显现象,若以I-形式存在,可用3%H2O2溶液氧化I-为I2,I2可以使淀粉溶液变蓝,故答案为:无明显现象/不变红;3%H2O2溶液并振荡;变蓝;
形式存在时,则Fe2+不会被氧化成Fe3+,加入KSCN溶液后无明显现象,若以I-形式存在,可用3%H2O2溶液氧化I-为I2,I2可以使淀粉溶液变蓝,故答案为:无明显现象/不变红;3%H2O2溶液并振荡;变蓝;
(4)根据题干信息,向溶液A中加入0.01mo1/LKMnO4溶液至溶液刚显浅红色,KMnO4和I-发生氧化还原反应,KMnO4将I-氧化为I2,MnO![]() 被还原为Mn2+,根据氧化还原反应得失电子守恒可得离子反应方程式为2MnO
被还原为Mn2+,根据氧化还原反应得失电子守恒可得离子反应方程式为2MnO![]() +10I-+16H+=2Mn2++5I2+8H2O,故答案为:2MnO
+10I-+16H+=2Mn2++5I2+8H2O,故答案为:2MnO![]() +10I-+16H+=2Mn2++5I2+8H2O。
+10I-+16H+=2Mn2++5I2+8H2O。