��Ŀ����
����Ŀ���Թ�ҵ�������������(SO2)�������������ã������ɷ�ֹ������Ⱦ������ʵ��һ������Ч�档�ش�����������
��1���Ȼ�ѧ����ѭ������,�漰����������Ӧ��
bunsen��Ӧ��SO2(g)+I2(g)+2H2O(l)�T2HI (g)+H2SO4(l) ��H
����ֽⷴӦ��2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) ��H=+462kJ��mol-1
�⻯��ֽⷴӦ��2HI(g)=H2(g)+I2(g)��H=+10kJ��mol-1
��֪������ȼ����Ϊ286kJ��mol-1,��bunsen��Ӧ����H=_________kJ��mol-1��
��2���ڻ���̿������SO2��Cl2������Ӧ��SO2(g)+Cl2(g)![]() SO2Cl2(g)��H<0���ڶ��¶�ѹ���������������Ϊ10L�������м�������ʵ�����SO2��Cl2����ֻ��(�������ʵ�����Ϊnmol)��,�ﵽƽ����������Ϊ8L��
SO2Cl2(g)��H<0���ڶ��¶�ѹ���������������Ϊ10L�������м�������ʵ�����SO2��Cl2����ֻ��(�������ʵ�����Ϊnmol)��,�ﵽƽ����������Ϊ8L��
��SO2Cl2����ˮ������������ԭ��Ӧ�����������ᣬ����������Ļ�ѧʽΪ_________��
��������ʵ����������Ϊ�ж���Ԫ�غ���Ԫ�طǽ�����ǿ����������_________(����ĸ)��
A������ķֽ��¶�Ϊ300�����ң��Ȼ���1500���ŷֽ�
B��������(H2S��ˮ��Һ)��һ�����ᣬ������ǿ��
C��������ͨ����������,��Һ�в�����ɫ����
D��������������������������ǿ
������������SO2��ƽ��ת������1=_________����Ӧ��ƽ�ⳣ��K=_________(��ʽ������)��
�����д�ʩ�в��ܽ�һ�����������ƽ��ת���ʵ���_________��
A��ƽ������������ѹ��Ϊ4L B��������������Ũ��
C�������¶� D����SO2Cl2(g)Һ������
������������г�ʼͶ��SO2��Cl2�����ʵ�����Ϊ0.5nmol����ﵽƽ��ʱSO2��ƽ��ת���ʣ���2_________����>����<������=��)��1��
���𰸡� +45 H2SO4��HCl B 40% ![]() =
= 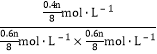 =
= ![]() mol��L-1 C =
mol��L-1 C =
����������1����������ȼ����286kJ��mol-1�ɵã���2H2(g)+O2(g)�T2H2O(l) ��H=��572kJmol��1����2HI(g)=H2(g)+I2(g) ��H=+10kJ��mol-1����2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) ��H=+462kJ��mol-1���ɸ�˹���ɿ�֪��(��+2����+��)��![]() ���Եõ��Ȼ�ѧ����ʽ2HI(g)+H2SO4(l)=SO2(g)+I2(g)+2H2O(l) ��H=��45KJ/mol�������淴Ӧ(Bunsen��Ӧ)���Ȼ�ѧ����ʽΪSO2(g)+I2(g)+2H2O(l)�T2HI (g)+H2SO4(l) ��H=+45KJ/mol��
���Եõ��Ȼ�ѧ����ʽ2HI(g)+H2SO4(l)=SO2(g)+I2(g)+2H2O(l) ��H=��45KJ/mol�������淴Ӧ(Bunsen��Ӧ)���Ȼ�ѧ����ʽΪSO2(g)+I2(g)+2H2O(l)�T2HI (g)+H2SO4(l) ��H=+45KJ/mol��
��2���ڻ���̿���£�SO2��Cl2������Ӧ��SO2(g)+Cl2(g)![]() SO2Cl2(g) ��H<0���ڶ��¶�ѹ�����£��������Ϊ10L�������м�������ʵ�����SO2��Cl2����ֻ��(�������ʵ�����Ϊnmol)��,�ﵽƽ����������Ϊ8L��
SO2Cl2(g) ��H<0���ڶ��¶�ѹ�����£��������Ϊ10L�������м�������ʵ�����SO2��Cl2����ֻ��(�������ʵ�����Ϊnmol)��,�ﵽƽ����������Ϊ8L��
��SO2Cl2����ˮ����ˮ�ⷴӦ�����������ᣬ��������ΪH2SO4��HCl��
��������ʵ�У�A������ķֽ��¶�Ϊ300�����ң��Ȼ���1500��ŷֽ��������Ȼ���������ȶ������Կ�֤���ȵķǽ����Ա���ǿ��B����������������ᶼ��������������Ӧ��ˮ����������������ǵ������ж�����ȵķǽ�����ǿ����C��������ͨ����������,��Һ�в�����ɫ������˵�� ���������������е����û�����������֤���ȵķǽ����Ա���ǿ��D��������������������������ǿ��ǿ����������֤���ȵķǽ����Ա���ǿ������������������Ϊ�ж���Ԫ�غ���Ԫ�طǽ�����ǿ����������B��
���ڶ��¶�ѹ�����£���������֮�ȵ��������ʵ���֮�ȡ����ԣ�![]() ����֮�ã�SO2��ƽ��ת������1=40%����Ӧ��ƽ�ⳣ��K=
����֮�ã�SO2��ƽ��ת������1=40%����Ӧ��ƽ�ⳣ��K=![]() =
= 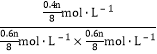 =
= ![]() mol��L-1��
mol��L-1��
�����д�ʩ����A��ƽ������������ѹ��Ϊ4L��ƽ��������Ӧ�����ƶ������Խ�һ�����������ƽ��ת������B��������������Ũ����ƽ��������Ӧ�����ƶ������Խ�һ�����������ƽ��ת������ C�����ڸ÷�ӦΪ���ȷ�Ӧ�������¶���ƽ�����淴Ӧ�����ƶ���������ƽ��ת���ʼ�С�� D����SO2Cl2(g)Һ�����룬���Լ�С�������Ũ�ȣ�ƽ��������Ӧ�����ƶ������Խ�һ�����������ƽ��ת���ʡ��������������ܽ�һ�����������ƽ��ת���ʵ���C��
������������г�ʼͶ��SO2��Cl2�����ʵ�����Ϊ0.5nmol����ͬ��ͬѹ�£�Ͷ�ϵı�����ƽ����ͬ���������ﵽƽ��ʱSO2��ƽ��ת���ʲ��䣬����2=��1��

����Ŀ����̼���ó�Ϊ����һ���µ��������������̼�IJ�����������Դ�����һ����Ҫ�о�������������ѧ֪ʶ�ش�
��1������CO2���������ȡ��ϩ��CO2��g��+3H2��g��![]() 1/2C2H4��g��+ 2H2O��g������ �÷�Ӧ��ϵ�������淴Ӧ���̱仯��ϵ����ͼ��ʾ�� ��÷�Ӧ����H =______���ú�a��b��ʽ�ӱ�ʾ����
1/2C2H4��g��+ 2H2O��g������ �÷�Ӧ��ϵ�������淴Ӧ���̱仯��ϵ����ͼ��ʾ�� ��÷�Ӧ����H =______���ú�a��b��ʽ�ӱ�ʾ����

��֪�����ֻ�ѧ���ļ������±���ʾ��ʵ����������Ӧ����H=-152kJmol��1������е�x=___________��
��ѧ�� | C=O | H-H | C=C | C-H | H-O |
����/kJmol��1 | 803 | 436 | x | 414 | 464 |
�� ��ϡ����Ϊ�������Һ������̫���ܵ�ؽ�CO2ת��Ϊ��ϩ�Ĺ���ԭ������ͼ��ʾ����N���ϵĵ缫��ӦʽΪ____________���õ��������������ܷ�Ӧ�Ļ�ѧ����ʽΪ__________��
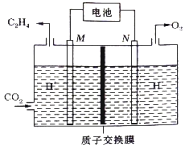
��2����CO2�����������ȡ���ѵķ�Ӧ���£�2CO2��g��+6H2��g��![]() CH3OCH3��g��+ 3H2O��g�� ��H=��122.5 kJmol��1��ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת��������ͼ��ʾ��
CH3OCH3��g��+ 3H2O��g�� ��H=��122.5 kJmol��1��ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת��������ͼ��ʾ��

��T1_______T2������<������=����>�������������__________________________��
��T1�¶��£���6 mol CO2��12mol H2����2 L���ܱ������У�����5 min��Ӧ�ﵽƽ�⣬��0�� 5 min�ڵ�ƽ����Ӧ�����ԣ�CH3OCH3��=______��
��һ�������£������ϳɶ����ѵķ�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ij�����������б仯��˵��ƽ��һ��������Ӧ�����ƶ�����______�����ţ���
A���淴Ӧ������������С B�������� c��H2��/c��CO2���ı�ֵ��С
C��H2��ת��������
����Ŀ�����ٵ����������̼���������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ������Ӧ�úʹ���̼�������仯�������������������Ҫ���塣
(1)���������������̼���о�һֱ�ǿƼ����ע���ص㡣�ڴ�����������H2��ԭCO2 �ǽ������ЧӦ����Ҫ�ֶ�֮һ,��ط�Ӧ����:
��֪H2 ��CH4��ȼ���ȷֱ�Ϊ285.5kJ/mol ��890.0kJ/mol��
H2O(1) =H2O(g) ��H= +44 kJ/mol
��д��H2 ��ԭCO2 ����CH4��H2O(g)���Ȼ�ѧ����ʽ_____________��
(2)CO2��Cu-ZnO����,��ͬʱ�������µķ�ӦI��II�������Ϊ�������ЧӦ����Դ��ȱ����Ҫ�ֶΡ�
I.CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ��H1=-57.8 kJ/mol
CH3OH(g) +H2O(g) ��H1=-57.8 kJ/mol
II.CO2(g) +H2(g)![]() CO(g) + H2O(g) ��H2 = +41.2 kJ/mol
CO(g) + H2O(g) ��H2 = +41.2 kJ/mol
��ij�¶�ʱ������ӦI���ٶ�v1���ڷ�ӦII���ٶ���v2,�����з�Ӧ���̵������仯��ȷ����_______(��ѡ��)��
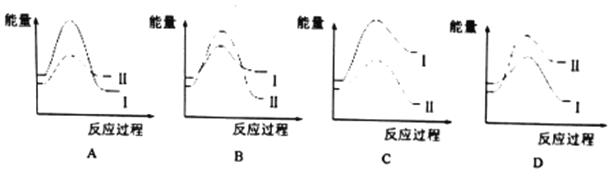
�ڶ�������μӵķ�Ӧ,����ʾƽ�ⳣ��Kpʱ,���������(B)��ƽ���ѹp(B)������������ʵ���Ũ��c(B)��
��֪:�������ֵķ�ѹp(B)��������ѹ���������������
��Cu-ZnO���ڵ������£������¶�Tʱ�����ݻ�������ܱ�������,����һ������CO2 ��H2����ʼ����ƽ��ʱ�������ڸ��������ʵ������±�:
CO2 | H2 | CH3OH | CO | H2O(g) | ��ѹ/kPa | |
��ʼ/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
ƽ��/mol | n1 | n2 | p |
����ӦI��II����ƽ��ʱ,P0=1.2p�������n1=____������ʱ
(3)����β���������γɵ�ԭ��֮һ���о���������Ĵ�����������Ч�����������γɣ��ɲ���������ԭ������:
4NO(g) +4NH3(g) +O2(g) ![]() 4N2(g) +6H2O(g) ��H <0
4N2(g) +6H2O(g) ��H <0
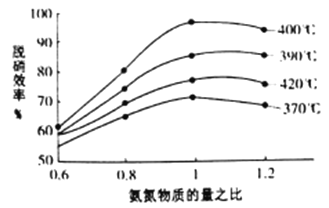
������ͼ�ж��������Ч�ʵ����������________;������һ��ʱ,��400��ʱ,����Ч�����,����ܵ�ԭ����______________��
(4)�û���̿��ԭ��Ҳ���Դ�����������,ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO,������Ӧ:C(s) +2NO(g)![]() N2(g) +CO2(g) ��H>0
N2(g) +CO2(g) ��H>0
��T��ʱ,��Ӧ���е���ͬʱ���ø����ʵ���Ũ������:
ʱ��/min Ũ��/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min��,ֻ�ı�ijһ����,�����ϱ��������жϸı������������_______��
A.ͨ��һ������CO2 B.������ʵĴ��� C.�ʵ���С���������
D.ͨ��һ������NO E.����һ�����Ļ���̿ F.�ʵ������¶�