题目内容
标准状况下,m g气体A与n g气体B分子数相同,下列说法中不正确的是( )
分析:标准状况下,分子数相同的气体A和B,它们的物质的量相同,则相对分子质量之比、气体的体积之比均等于质量之比、分子数之比与物质的摩尔质量成反比,由ρ=
来分析密度之比.
| m |
| V |
解答:解:A.标准状况下,Vm相同,由ρ=
可知,密度之比等于摩尔质量之比等于相对分子质量之比,即为m:n,故A错误;
B.由n=
可知,分子数相同的气体,相对分子质量之比等于质量之比,即A与B相对分子质量之比为mg:ng=m:n,故B正确;
C.A与B相对分子质量之比为m:n,同质量时由n=
可知,分子数之比等于
:
=n:m,故C正确;
D.相同状况下,同体积的A与B的物质的量相同,则质量之比等于相对分子质量之比,即为m:n,故D正确;
故选A.
| m |
| V |
B.由n=
| m |
| M |
C.A与B相对分子质量之比为m:n,同质量时由n=
| m |
| M |
| 1 |
| m |
| 1 |
| n |
D.相同状况下,同体积的A与B的物质的量相同,则质量之比等于相对分子质量之比,即为m:n,故D正确;
故选A.
点评:本题考查阿伏伽德罗定律及其推论,明确同温、同压、同体积,则气体的分子数相同、物质的量相同及质量、物质的量、摩尔质量的关系是解答的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
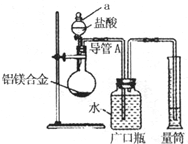 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.
含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.