题目内容
【题目】请回答下列问题:
(1)纯水在T ℃时,pH=6,该温度下1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=_______mol·L-1。
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A)___pH(B) (填“>”、“=”或“<”);
现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A) _____V(B)(填“>”、“=”或“<”)。
(3)25℃时,0.05mol/LH2SO4溶液的pH=_________;0.05mol/LBa(OH)2溶液中的c(H+)=_______。
(4)某温度下纯水中的c(H+)=2×10-7mol/L,则此时水中的c(OH-)=____________;若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L,则溶液中c(OH-)=_________,此时溶液中由水电离产生的c(H+)=_________。
【答案】 10-12 < < 1 1×10-13mol/L 2×10-7 mol/L 8×10-11 mol/L 8×10-11 mol/L
【解析】(1)纯水在100 ℃时,pH=6,即c(H+)=c(OH-)=10-6 mol·L-1,可知Kw=10-12,1 mol·L-1的NaOH溶液中由水电离出的c(OH-)取决于溶液中的c(H+),即c水电离(OH-)=c(H+)=10-12 mol·L-1;(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等,则弱酸有大部分电离,加水稀释时,能够促进更多的弱酸电离,所以加水稀释后,氢离子浓度大于二元强酸中氢离子浓度,所以pHA<pHB,上述稀释溶液中弱酸的氢离子的物质的量浓度大于强酸,所以等体积含有的氢离子的物质的量多,中和等浓度等体积的NaOH溶液,用的体积少,现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A)<V(B);(3)25℃时,0.05mol/LH2SO4溶液的c(H+)=0.05mol/L×2=0.1mol/L, pH=1;0.05mol/LBa(OH)2溶液中的c(OH-)=0.05mol/L×2=0.1mol/L,c(H+)=![]() =10-13mol/L;(4)某温度下纯水中的c(H+)=2×10-7 mol/L,则此时溶液中的c(OH-)=2×10-7mol/L,Kw= c(H+)c(OH-)=2×10-7mol/L×2×10-7mol/L=4×10-14,若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L,c(OH-)=
=10-13mol/L;(4)某温度下纯水中的c(H+)=2×10-7 mol/L,则此时溶液中的c(OH-)=2×10-7mol/L,Kw= c(H+)c(OH-)=2×10-7mol/L×2×10-7mol/L=4×10-14,若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L,c(OH-)=![]() =8×10-11mol/L,温度不变,水的离子积常数不变,酸抑制水电离,所以水的电离程度减小,此时溶液中由水电离产生的c(H+)=8×10-11 mol/L。
=8×10-11mol/L,温度不变,水的离子积常数不变,酸抑制水电离,所以水的电离程度减小,此时溶液中由水电离产生的c(H+)=8×10-11 mol/L。

【题目】Ⅰ、由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
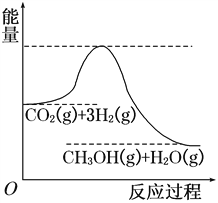
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
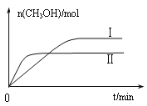
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
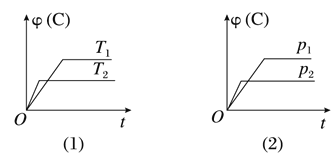
Ⅱ、(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示(T1、T2均大于300℃)
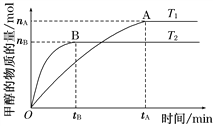
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。