题目内容
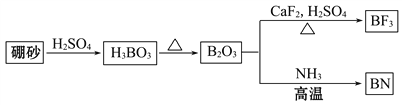
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________________、__________________________。
(2)基态B原子的电子排布式为________,B和N相比,电负性较大的是________,BN中B元素的化合价为________。
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为________。
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
【答案】 B2O3+3CaF2+3H2SO4![]() 3CaSO4+2BF3↑+3H2O B2O3+2NH3
3CaSO4+2BF3↑+3H2O B2O3+2NH3![]() 2BN+3H2O 1s22s22p1 N +3 120° sp2 正四面体形 共价键(或极性共价键) 分子间作用力 4 4
2BN+3H2O 1s22s22p1 N +3 120° sp2 正四面体形 共价键(或极性共价键) 分子间作用力 4 4 ![]()
【解析】(1)由图可知B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水, B2O3与氨气在高温下反应即生成BN。
(2)基态B原子的电子排布式为1s22s22p1;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3。
(3)依据价层电子对互斥理论,计算出BF3的孤对电子对数为0,并且价层电子对数为3,所以BF3分子为平面正三角形结构,键角为120°,杂化方式为sp2;BF4-中心原子的孤对电子对数为0,其价层电子对数为4,所以其结构为正四面体.故答案为:120°;sp2;正四面体;
(4)B、N均属于非金属元素,二者形成的化学键是极性共价键;根据石墨结构可知六方氮化硼晶体中,层与层之间靠分子间作用力结合。
(5)根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数8,则一个立方氮化硼晶胞中含有4个N原子和4个B原子.一个晶胞中的质量为25×4g/NA,一个立方氮化硼晶胞的体积是(361.5×10-10cm)3,其密度为,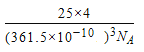 。
。

 阅读快车系列答案
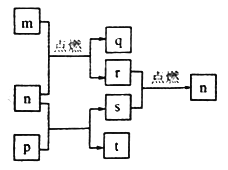
阅读快车系列答案【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
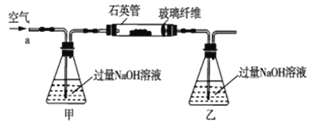
(实验一)测定硫元素的含量
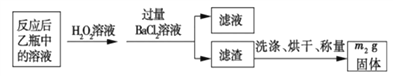
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00mL稀释液,用0.100mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
【题目】已知下列元素的原子半径,根据表中数据推测磷原子的半径可能是
原子 | N | S | O | Si |
半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10mB.1.10×10-10mC.1.20×10-10mD.0.70×10-10m