题目内容
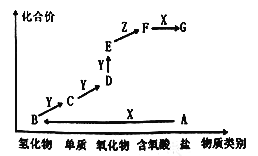
【题目】实验是化学研究的一种重要手段,现有图所示A-G七种仪器,请根据要求填空。

(I)写出仪器名称:F_________。
(II)下列实验操作中用到仪器G的是_______(选填下列选项的编号字母)。
a.分离水和CC14的混合物b.分离水和酒精的混合物c.分离水和泥砂的混合物
(III)配制480mL、0.2molL-1CuSO4溶液。
(1)应用托盘天平称取CuSO45H2O晶体____________,
(2)使用容量瓶前必须进行的一步操作是________,在容量瓶上需标记的是____________(填字母),
a.温度b.刻度线c.浓度d.容积
(3)所需仪器除了烧杯、玻璃棒、托盘天平外,还缺少__________________,
(4)实验中两次用到玻璃棒,起作用分别是____________、____________。
(5)配制溶液时除了称量、溶解、冷却、转移溶液、摇匀操作外,还缺少:__________________(填操作名称)。
(6)若实验中有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
a.胆矾失去了部分结晶水____________;
b.定容时加水超过刻度线____________;
c.最终定容时仰视观察液面____________;
d.容量瓶不干燥,含有少量蒸馏水____________。
【答案】冷凝管 a 25.0g 验漏 AB D 500ml容量瓶、胶头滴管 搅拌 引流 洗涤、定容 偏高 偏低 偏低 无影响
【解析】
(1)根据仪器的特点分析仪器的名称。
(2)根据仪器的特点分析仪器的用途,分液为分离不互溶的液体混合物的方法。
(3)根据n=m/M和c=n/V,计算所需要的溶质的质量,注意容量瓶的规格。
(4)根据配制溶液的过程和使用的仪器分析其用途。
(5)根据配制过程中溶质或溶液体积的影响分析浓度的变化。
(I)仪器F为冷凝管;
(II)仪器G为分液漏斗,用于分液操作,分离不互溶的液体混合物,故适合分离a;
(III) (1) CuSO45H2O的质量为0.2mol/L×0.5L×250g/mol=25.0g;
(2)容量瓶使用前先验漏;容量瓶上有温度和刻度线和溶剂,没有浓度标志,故选 AB D;
(3)没有480mL的容量瓶,应选择 500ml容量瓶,实验过程中需要使用胶头滴管;
(4)溶解溶质时玻璃棒的作用为搅拌,向容量瓶中转移溶液时使用玻璃棒的作用为引流;
(5) 配制溶液时除了称量、溶解、冷却、转移溶液、洗涤、定容、摇匀;
(6). a.胆矾失去了部分结晶水,则称量的固体中硫酸铜变多,则浓度偏高;b.定容时加水超过刻度线,溶液的体积变大,浓度偏低;c.最终定容时仰视观察液面,溶液的体积变大,浓度偏低;d.容量瓶不干燥,含有少量蒸馏水偏高,对浓度无影响。

【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A. 实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K= 1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如图:
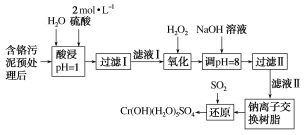
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
③Cr(OH)(H2O)5SO4是难溶物。
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ | |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480 mL2mol·L-1的硫酸,需要量取浓硫酸___mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_____。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为___(填微粒的化学式)。
(4)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有___。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:__。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是___(填编号),滴定终点的现象是___。
A.NaCl B.K2CrO4 C.KI D.NaCN