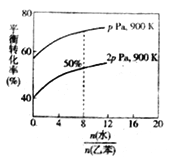
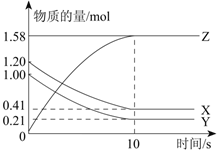
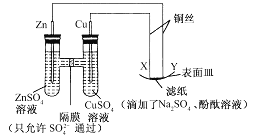
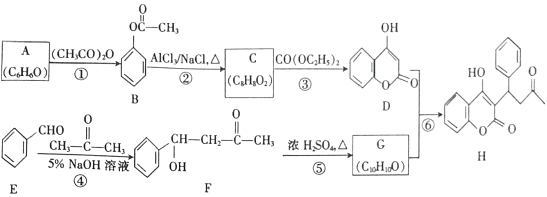
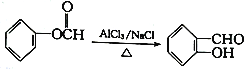题目内容
【题目】饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________________________。
【答案】Al 失去 N 还原 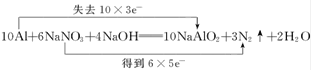
【解析】
(1)在该化学反应中,Al元素的化合价由0价上升到+3价,失去电子,属于还原剂,在反应过程中被氧化,N元素的化合价由+5价降低至0价,得到电子,属于氧化剂,在反应过程中被还原;
(2)根据反应中元素的化合价的变化可以得到转移的电子总数=还原剂失去的电子=氧化剂得到的电子=30mol,“双线桥法”表示如图:

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目