题目内容
【题目】苯乙烯是工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:![]() (g)
(g)![]()
![]() (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为________kJ·mol-1(用含有Q、b、c的表达式表示,其中Q、b、c均大于0)。
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a________5。
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
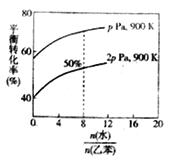
①加入水蒸气稀释剂能提高乙苯转化率的原因是___________________________。
②用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=________。
③改变下列条件,能使乙苯的反应速率和转化率一定增大的是________(填标号)。
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛:![]() (g)+2O2→
(g)+2O2→![]() + CO2+H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为_________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________mol。
+ CO2+H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为_________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________mol。
【答案】 (Q+a-b) > 保持总压不变,充入水蒸气,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大(或体系总压强不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,乙苯转化率增大) ![]() B
B ![]() -8e-+3H2O=
-8e-+3H2O=![]() +8H++CO2 2
+8H++CO2 2
【解析】(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则
①C6H5-C2H5(g)+21/2O2(g)→8CO2(g)+5H2O(l) △H=-a kJ·mol-1
②C6H5-C2H3(g)+10O2(g)→8CO2(g)+4H2O(l) △H=-b kJ·mol-1
又因为③C6H5-C2H5(g)![]() C6H5-C2H3(g)+H2(g) △H=+QkJ·mol-1
C6H5-C2H3(g)+H2(g) △H=+QkJ·mol-1
所以根据盖斯定律可知①-②-③即可得到1/2O2(g)+H2(g)=H2O(l) △H=-(Q+a-b) kJ·mol-1,因此氢气的燃烧热为(Q+a-b)kJ·mol-1。
(2)根据方程式可知正反应是体积增大的可逆反应,平衡后若再充入amol的乙苯(g)相当于是增大压强平衡向逆反应方向进行,由于重新达到平衡后容器内气体的压强为2p1,即气体的物质的量是原来的2倍,而逆反应是体积减小的,所以a>5。(3)①由于保持总压不变,充入水蒸气,容器体积增大,各组分的浓度同倍数减小,有利于反应正向进行,因此乙苯转化率增大。②设乙苯的起始量是1mol,水蒸气是8mol,则根据方程式和图像可知
C6H5-C2H5(g)![]() C6H5-C2H3(g)+H2(g)
C6H5-C2H3(g)+H2(g)
起始量(mol) 1 0 0
转化量(mol) 0.5 0.5 0.5
平衡量(mol) 0.5 0.5 0.5
则900K时的平衡常数Kp=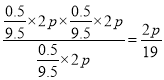 ;③A.恒容时加入稀释剂水蒸气,反应物浓度不变,反应速率和转化率均不变,A错误;B.正反应吸热,压强不变下,温度升至1500 K反应速率增大,平衡向正反应方向进行,转化率一定增大,B正确;C.在容积和温度不变下充入Ar,反应物浓度不变,反应速率和转化率均不变,C错误;D.选用催化效果更好的催化剂可以改变反应速率,但不能改变平衡状态,转化率不变,D错误,答案选B;(4)负极发生失去电子的氧化反应,则电池负极是苯乙烯失去电子,由于溶液显酸性,则负极的电极反应式为C6H5-CH=CH2-8e-+3H2O=C6H5-CHO+8H++CO2。若该电池消耗标准状况下11.2 L的O2,氧气的物质的量是0.5mol,所以外电路中理论上应转移电子的物质的量为0.5mol×4=2mol。
;③A.恒容时加入稀释剂水蒸气,反应物浓度不变,反应速率和转化率均不变,A错误;B.正反应吸热,压强不变下,温度升至1500 K反应速率增大,平衡向正反应方向进行,转化率一定增大,B正确;C.在容积和温度不变下充入Ar,反应物浓度不变,反应速率和转化率均不变,C错误;D.选用催化效果更好的催化剂可以改变反应速率,但不能改变平衡状态,转化率不变,D错误,答案选B;(4)负极发生失去电子的氧化反应,则电池负极是苯乙烯失去电子,由于溶液显酸性,则负极的电极反应式为C6H5-CH=CH2-8e-+3H2O=C6H5-CHO+8H++CO2。若该电池消耗标准状况下11.2 L的O2,氧气的物质的量是0.5mol,所以外电路中理论上应转移电子的物质的量为0.5mol×4=2mol。