题目内容
【题目】几种短周期元素的原子半径及主要化合价如下表:
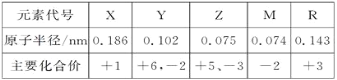
已知X是短周期中最活泼的金属,且与R同周期。下列叙述不正确的是( )
A.离子半径大小:R3+<X+<M2-
B.Y与M组成的化合物是形成光化学烟雾的原因之一
C.将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生
D.M的氢化物的熔、沸点高于Z的氢化物的熔、沸点
【答案】B
【解析】
X是短周期中最活泼的金属,则X是Na;R与X同周期,且主要化合价为+3,则R为Al;Y和M主要化合价均有-2价,且Y有+6价,则Y为S,M为O;Z的原子半径比Y(S)小且主要化合价为+5、-3,则Z为N,综上所述,X、Y、Z、M、R分别为:Na、S、N、O、Al,据此解答。
A.R为Al,X为Na,M为O,R3+、X+、M2-均含2个电子层,核电荷数:R3+>X+>M2-,核外电子排布相同的离子,核电荷数越大,离子半径越小,故离子半径:R3+<X+<M2-,A正确;
B.Y为S,M为O,氮氧化物是形成光化学烟雾的原因之一,不是硫氧化物,B错误;
C.YM2即SO2,SO2与水反应生成亚硫酸,NO3-在酸性条件下有强氧化性,将SO2氧化成SO42-,SO42-和Ba2+反应生成BaSO4沉淀,C正确;
D.M为O,其简单氢化物为H2O,常温呈液态,Z为N,其简单氢化物为NH3,常温呈气态,故M(O)的氢化物的熔、沸点高于Z(N)的氢化物的熔、沸点,D正确。
答案选B。

 阅读快车系列答案
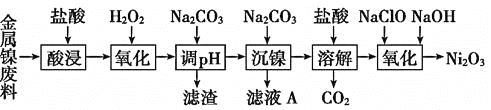
阅读快车系列答案【题目】三氧化二镍![]() 是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料
是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料![]() 含有少量的铁、铝等杂质
含有少量的铁、铝等杂质![]() ,继而生产
,继而生产![]() 的工艺流程如下:
的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() 。
。
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有______
A. 降低温度 ![]() 搅拌
搅拌 ![]() 减少盐酸的浓度
减少盐酸的浓度 ![]() 将废料研成粉末
将废料研成粉末
(2)酸浸后的酸性溶液中加入![]() 的目的:__________。沉镍前需加
的目的:__________。沉镍前需加![]() 控制溶液pH范围为______,所得到滤渣的主要成分是_______。
控制溶液pH范围为______,所得到滤渣的主要成分是_______。
(3)从滤液A中可回收利用的主要物质是![]() 和________。
和________。
(4)“氧化”生成![]() 的离子方程式为__________________________。
的离子方程式为__________________________。
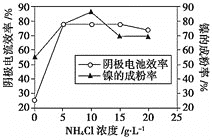
(5)工业上用镍为阳极,电解![]() 溶液与一定量
溶液与一定量![]() 组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,
组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,![]() 的浓度对阴极电流效率及镍的成粉率的影响如图所示,则
的浓度对阴极电流效率及镍的成粉率的影响如图所示,则![]() 的浓度最好控制为_________。
的浓度最好控制为_________。