题目内容
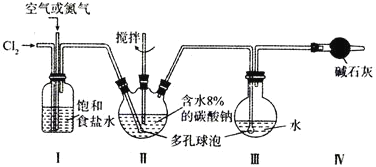
【题目】某实验室用下图所示装置制备高浓度的次氯酸,先在Ⅱ中生成![]() ,再在Ⅲ中得到HClO溶液。
,再在Ⅲ中得到HClO溶液。
已知:![]() 的沸点为
的沸点为![]() ,
,![]() 以上分解为
以上分解为![]() 和
和![]() ;
;![]() 极易溶于水并与水反应生成HClO。
极易溶于水并与水反应生成HClO。
(1)反应中通入空气或氮气的作用是________________,实验中控制氯气与空气或氮气的体积比的方法是_________。
(2)装置Ⅱ、Ⅲ中使用多孔球泡的作用是_________;装置Ⅱ中发生反应的化学方程式为_________。
(3)反应时,Ⅱ中要加装冷却装置,其原因是__________。
(4)已知次氯酸可被![]() 还原成
还原成![]() ,可利用此原理测定Ⅲ中所得次氯酸溶液的物质的量浓度。
,可利用此原理测定Ⅲ中所得次氯酸溶液的物质的量浓度。
![]() 此反应的化学方程式为__________________________。
此反应的化学方程式为__________________________。
![]() 量取
量取![]() 次氯酸溶液于烧杯中,加入足量的
次氯酸溶液于烧杯中,加入足量的![]() 溶液,混合均匀后再加入足量的
溶液,混合均匀后再加入足量的![]() 溶液,反应完全后过滤,洗涤,干燥,用电子天平称量,得到固体
溶液,反应完全后过滤,洗涤,干燥,用电子天平称量,得到固体![]() ,则所制取次氯酸的浓度为______
,则所制取次氯酸的浓度为______![]() 。
。
(5)若制得上述次氯酸溶液![]() ,转化过程中氯的损耗为
,转化过程中氯的损耗为![]() ,则至少需要标况下
,则至少需要标况下![]() __________L。
__________L。
【答案】不断通入空气或![]() ,从而稀释了
,从而稀释了![]() 或
或![]() 起到了防止倒吸的作用 通过观察Ⅰ中产生气泡的速率调节流速 增加气体与溶液的接触面积,使反应充分进行
起到了防止倒吸的作用 通过观察Ⅰ中产生气泡的速率调节流速 增加气体与溶液的接触面积,使反应充分进行 ![]() 防止温度较高时
防止温度较高时![]() 发生分解,使产生的
发生分解,使产生的![]() 大量减少
大量减少 ![]()
![]()
![]()
【解析】
![]() 根据反应前后气压变化判断作用;观察实验现象控制反应快慢;
根据反应前后气压变化判断作用;观察实验现象控制反应快慢;
![]() 使用多孔球泡的作用是增加气体与溶液的接触面积,使反应充分进行;根据题目信息,氯气与碳酸钠溶液反应时产生一氧化二氯,完成对应的化学方程式;
使用多孔球泡的作用是增加气体与溶液的接触面积,使反应充分进行;根据题目信息,氯气与碳酸钠溶液反应时产生一氧化二氯,完成对应的化学方程式;
![]() 由于
由于![]() 以上分解为
以上分解为![]() 和
和![]() ,Ⅱ中要加装冷却装置的原因是防止温度较高时
,Ⅱ中要加装冷却装置的原因是防止温度较高时![]() 发生分解;
发生分解;
![]() 次氯酸可被
次氯酸可被![]() 还原成
还原成![]() ,该反应中过氧化氢做还原剂,次氯酸做氧化剂,完成化学方程式;
,该反应中过氧化氢做还原剂,次氯酸做氧化剂,完成化学方程式;
![]() 可以利用氯化银的质量求出氯化银的物质的量,利用氯元素守恒HClO_HCl-AgCl,利用c=
可以利用氯化银的质量求出氯化银的物质的量,利用氯元素守恒HClO_HCl-AgCl,利用c=![]() ,进行计算;
,进行计算;
(5)利用氯元素守恒,次氯酸的物质的量即氯气的物质的量,有20%的损耗,算出的氯气的物质的量除以80%,换算成标况下的体积。
![]() 由于氯气与碳酸钠溶液反应时可能会倒吸,因此不断通入空气或
由于氯气与碳酸钠溶液反应时可能会倒吸,因此不断通入空气或![]() ,从而稀释了
,从而稀释了![]() 或
或![]() 起到了防止倒吸的作用;实验中控制氯气与空气或氮气的体积比的方法是通过观察Ⅰ中产生气泡的速率调节流速;
起到了防止倒吸的作用;实验中控制氯气与空气或氮气的体积比的方法是通过观察Ⅰ中产生气泡的速率调节流速;
![]() 使用多孔球泡的作用是增加气体与溶液的接触面积,使反应充分进行;根据题目信息,氯气与碳酸钠溶液反应时产生一氧化二氯,所以对应的化学方程式为:
使用多孔球泡的作用是增加气体与溶液的接触面积,使反应充分进行;根据题目信息,氯气与碳酸钠溶液反应时产生一氧化二氯,所以对应的化学方程式为:![]() ;
;
![]() 由于
由于![]() 以上分解为
以上分解为![]() 和
和![]() ,Ⅱ中要加装冷却装置的原因是防止温度较高时
,Ⅱ中要加装冷却装置的原因是防止温度较高时![]() 发生分解,使产生的
发生分解,使产生的![]() 大量减少;故答案为 (5). 防止温度较高时
大量减少;故答案为 (5). 防止温度较高时![]() 发生分解,使产生的
发生分解,使产生的![]() 大量减少;
大量减少;
![]() 次氯酸可被
次氯酸可被![]() 还原成
还原成![]() ,该反应中过氧化氢做还原剂,次氯酸做氧化剂,对应的化学方程式为:
,该反应中过氧化氢做还原剂,次氯酸做氧化剂,对应的化学方程式为:![]() ;
;
![]() 根据题目信息,结合
根据题目信息,结合![]() 中的反应,氯元素守恒,HClO~~HCl~~AgCl,nAgCl=
中的反应,氯元素守恒,HClO~~HCl~~AgCl,nAgCl=![]() ,可知次氯酸的物质的量浓度为
,可知次氯酸的物质的量浓度为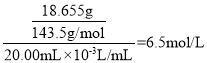 ;
;
![]() 根据题给信息和
根据题给信息和![]() 中的反应可知,利用氯元素守恒,次氯酸的物质的量即氯气的物质的量,有20%的损耗,算出的氯气的物质的量除以80%,换算成标况下的体积,需要标况下氯气的体积为
中的反应可知,利用氯元素守恒,次氯酸的物质的量即氯气的物质的量,有20%的损耗,算出的氯气的物质的量除以80%,换算成标况下的体积,需要标况下氯气的体积为![]() 。
。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案