题目内容
【题目】CO、H2、CH3、OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) △H1
H2O(g)+CO(g)==H2(g) + CO2(g) △H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) △H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g) ![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②p1_____p2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为p1、温度为T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(3)甲醇燃料电池是一种具有高能量转化率的绿色电池,则用磷酸溶液作电解质时,负极的电极反应式为________________________。
【答案】 -566 -107 > > 4. 5 无法确定 CH3OH+H2O-6e-==CO2↑+6H+
【解析】 (1) 2CO(g) +O2(g)==2CO2(g) △H1=反应物总键能-生成物总键能=958.5×2+497-745×4= -566 kJmol-1;①2CO(g) +O2(g)==2CO2(g) △H1= -566 kJmol-1;②H2O(g)+CO(g)==H2(g) + CO2(g) △H2 = -41 kJmol-1,③CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) △H3 = -660kJmol-1,根据盖斯定律,将①×![]() -②×2-③得反应CO(g)+2H2(g)
-②×2-③得反应CO(g)+2H2(g) ![]() CH3OH(g)△H=(-566)×
CH3OH(g)△H=(-566)×![]() -(-41)×2-(-660)=-107kJmol-1,故答案为:-566;-107;
-(-41)×2-(-660)=-107kJmol-1,故答案为:-566;-107;
(2) ①CO(g)+2H2(g) ![]() CH3OH(g)△H=-107kJmol-1,为放热反应。升高温度,平衡逆向移动,CH3OH的体积百分含量减小,因此T1<T2,温度越高,反应速率越快,达到平衡所需要的时间越短,因此t1> t2,故答案为:>;
CH3OH(g)△H=-107kJmol-1,为放热反应。升高温度,平衡逆向移动,CH3OH的体积百分含量减小,因此T1<T2,温度越高,反应速率越快,达到平衡所需要的时间越短,因此t1> t2,故答案为:>;
②CO(g)+2H2(g) ![]() CH3OH(g)△H=-107kJmol-1,相同温度下,增大压强,平衡正向移动,H2的平衡转化率增大,则p1>p2,故答案为:>;
CH3OH(g)△H=-107kJmol-1,相同温度下,增大压强,平衡正向移动,H2的平衡转化率增大,则p1>p2,故答案为:>;
③ CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始(mol) 2 4 0
反应(mol) x 2x x
平衡(mol) 2-x 4-2x x
则![]() ×100%=40%,解得x=
×100%=40%,解得x=![]() mol,T1时该反应的平衡常数K=
mol,T1时该反应的平衡常数K=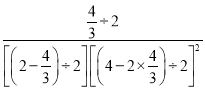 =4.5,故答案为:4.5;
=4.5,故答案为:4.5;
④在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,设三种气体的物质的量分别为n,则Qc=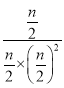 =
=![]() ,无法比较与K的大小,因此无法确定v(CH3OH)正与v(CH3OH)逆的大小,故答案为:无法确定;
,无法比较与K的大小,因此无法确定v(CH3OH)正与v(CH3OH)逆的大小,故答案为:无法确定;
(3) 用磷酸溶液作电解质时,负极上甲醇发生氧化反应生成二氧化碳,电极反应式为CH3OH+H2O-6e-==CO2↑+6H+,故答案为:CH3OH+H2O-6e-==CO2↑+6H+。
