题目内容
【题目】为探究绿色固体X(含四种元素)的组成和性质,设计并完成如下实验:
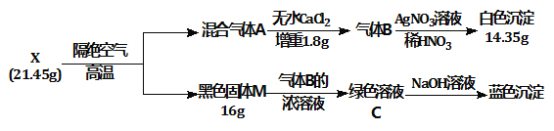
请回答:
(1) X的化学式是________。
(2) 绿色溶液C蒸干灼烧得到固体M,总反应的化学方程式是___________________________。
(3) 加热条件气体B能与氧气发生置换反应,写出该反应的化学方程式_____________________。
【答案】Cu2(OH)3Cl CuCl2+H2O![]() CuO+2HCl 4HCl+O2
CuO+2HCl 4HCl+O2![]() 2H2O+2Cl2
2H2O+2Cl2
【解析】
根据流程中信息可知,21.45gX隔绝空气高温加热后得到16g黑色固体M和混合气体A,混合气体A通过无水氯化钙,无水氯化钙增重1.8g,为0.1molH2O,得到气体B,气体B与稀硝酸酸化的硝酸银溶液作用后产生白色沉淀,且加热条件气体B能与氧气发生置换反应,则气体B为HCl;14.35g白色沉淀为氯化银,物质的量为![]() ,故可知HCl的物质的量为0.1mol;固体M在B的浓溶液浓盐酸作用下得到绿色溶液C,绿色溶液与氢氧化钠反应生成蓝色沉淀,故综上可推出C为氯化铜溶液,D为氢氧化铜,则固体M为氧化铜,故可知16gCuO的物质的量为0.2mol;根据质量守恒可知,X含四种元素为Cu、Cl、O、H,21.45gX含有0.2 molCu,0.1molCl,0.1+0.2mol=0.3molO,0.1mol×2+0.1mol=0.3molH,结合元素化合价可知,X为Cu2(OH)3Cl;
,故可知HCl的物质的量为0.1mol;固体M在B的浓溶液浓盐酸作用下得到绿色溶液C,绿色溶液与氢氧化钠反应生成蓝色沉淀,故综上可推出C为氯化铜溶液,D为氢氧化铜,则固体M为氧化铜,故可知16gCuO的物质的量为0.2mol;根据质量守恒可知,X含四种元素为Cu、Cl、O、H,21.45gX含有0.2 molCu,0.1molCl,0.1+0.2mol=0.3molO,0.1mol×2+0.1mol=0.3molH,结合元素化合价可知,X为Cu2(OH)3Cl;
(1) X的化学式是Cu2(OH)3Cl;
(2) 绿色溶液C蒸干灼烧得到固体M,总反应的化学方程式是CuCl2+H2O![]() CuO+2HCl;
CuO+2HCl;
(3) 加热条件气体B能与氧气发生置换反应,B为HCl,与氧气反应生成氯气和水,反应的化学方程式为4HCl+O2![]() 2H2O+2Cl2。
2H2O+2Cl2。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆
【题目】W溶液受热会发生分解反应。体积均为2L的4组溶液(忽略反应前后体积的变化),W的物质的量随时间的变化如表,则下列说法不正确的是( )
0min | 10min | 20min | 30min | 40min | 50min | 60min | ||
① | 10°C | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10°C | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25°C | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30°C | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A. 在10-20min内,实验①中W的平均分解速率为0.005molL-1min-1
B. a>1.1,且说明浓度越大,反应速率越快
C. 对比①和③,说明温度越高,反应速率越快
D. 对比①和④,不能说明同一时刻W的平均反应速率随温度升高而增大