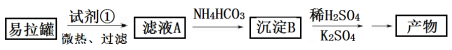题目内容
(B类题)将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位。炼铁高炉中发生的关键反应如下:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
CO2(g)+C(s)=2CO(g) ΔH=+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+ O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
根据上面三个热化学方程式,回答下列问题:
(1)CO的燃烧热为____________;写出其热化学方程式 。
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为 。
(3)炼制1 t(吨)含铁96%的生铁所需焦炭的理论用量是________t(结果保留两位有效数字),实际生产中所需焦炭远高于理论用量,其原因是 。
练习册系列答案
相关题目


 2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得v(D)=0.25 mol/(L·min),则下列推断正确的是
2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得v(D)=0.25 mol/(L·min),则下列推断正确的是 、Mg杂质)制备明矾的过程如下图所示。
、Mg杂质)制备明矾的过程如下图所示。