��Ŀ����
����Ŀ��������ˮ������ҵ��ɰ�ǡ���֬��Ư����ɱ�������У��������ƣ�NaClO2����������Ҫ�����ã���ͼ�������������ƵĹ�������ͼ�� 
��֪����NaClO2���ܽ�����¶����߶������ʵ������¿ɽᾧ����NaClO23H2O��
�ڳ����£�Ksp��FeS��=6.3��10��18��Ksp��CuS��=6.3��10��36��Ksp��PbS��=8��10��28
�ۢ�װ���е����������Һ����������������ͬʱ�������ᣬ��������������ͬʱ�����������ƣ�
��1��I�з�����Ӧ�����ӷ���ʽΪ ��
��2������Һ�еõ�NaClO23H2O����������������������д��ţ���
a������ b������Ũ�� c������ d����ȴ�ᾧ e������
��3��ӡȾ��ҵ�����������ƣ�NaClO2��Ư��֯�Ư��֯��ʱ���������õ���HClO2 �� ����25��ʱHClO2�����ֳ�������ĵ���ƽ�ⳣ����
���� | HClO2 | HF | H2CO3 | H2S |
Ka/molL��1 | 1��10��2 | 6.3��10��4 | K1=4.30��10��7 | K1=9.1��10��8 |
�ٳ����£����ʵ���Ũ����ȵ�NaClO2��NaF��NaHCO3��Na2S������Һ��pH�ɴ�С��˳��Ϊ���û�ѧʽ��ʾ����
��Na2S�dz��õij�������ij��ҵ��ˮ�к��е�Ũ�ȵ�Cu2+��Fe2+��Pb2+���ӣ��μ�Na2S��Һ�����������ij������������£������һ�����ӳ�����ȫʱ��������Ũ��Ϊ10��5molL��1����ʱ��ϵ�е�S2����Ũ��Ϊ ��
��4����װ��������������a�����Ϊ1.12L����״��������ת�Ƶ��ӵ����ʵ���Ϊ
���𰸡�
��1��SO32��+2ClO3��+2H+=2C1O2+SO42��+H2O
��2��bdc
��3��pH��Na2S����pH��NaHCO3����pH��NaF����pH��NaClO2����CuS��6.3��10��13mol/L
��4��0.2mol
���������⣺��1��������ͼ��֪I��Ŀ���Dz���C1O2 �� SO32�����л�ԭ�ԣ���ClO3����ԭΪC1O2 �� ����������ΪSO42�� �� ��Ӧ�����ӷ���ʽΪ��SO32��+2ClO3��+2H+=2C1O2+SO42��+H2O�����Դ��ǣ�SO32��+2ClO3��+2H+=2C1O2+SO42��+H2O����2������Һ�еõ����ᾧˮ�ľ��壬һ���ȡ����Ũ������ȴ�ᾧ������ͨ�����˵õ��־��壬���Բ���˳��Ϊ��bdc�����Դ��ǣ�bdc����3���ٸ��ݵ���ƽ�ⳣ����֪����ǿ��˳��Ϊ��HClO2��HF��H2CO3��HS�� �� ����Խ������Ӧ�������������ˮ��̶�Խ����Һ��PHԽ�����ʵ���Ũ����ȸ���ҺpH��ϵΪ��pH��Na2S����pH��NaHCO3����pH��NaF����pH��NaClO2����
���Դ��ǣ�pH��Na2S����pH��NaHCO3����pH��NaF����pH��NaClO2����
��Ksp��FeS��=6.3��10��18��Ksp��CuS��=6.3��10��28��Ksp��PbS��=2.4��10��28 �� �������������ͬ���ܶȻ�ԽС���ܽ��ԽС���μ����ƣ���Ӧ���������ȳ���������������������CuS���������������FeS�������һ�����ӳ�����ȫʱ��������Ũ��Ϊ10��5molL��1������ʱ��S2����Ũ��c��S2����= ![]() =
= ![]() mol/L=6.3��10��13mol/L��
mol/L=6.3��10��13mol/L��
���Դ��ǣ�CuS��6.3��10��13mol/L����4����ͼ֪��III�е������Na2SO4 �� ���Na2SO4��Һʱ����������������ͬʱ�������ᣬ��������������ͬʱ�����������ƣ��������ϵ缫��ӦʽΪ��2H2O��4e��=O2��+4H+ �� �����缫��ӦʽΪ��2H2O+2e��=H2��+2OH�� �� ����������ᣬ����a������������b������������A��NaOH��A�����������ɣ���������a�ĵ缫��Ӧʽ��2H2O��4e��=O2��+4H+ �� ��������a�����Ϊ1.12L����״������0.05mol��ת�Ƶ��ӵ����ʵ���Ϊ0.05mol��4=0.2mol��
���Դ��ǣ�0.2mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ʵ���ܴﵽ��Ӧʵ��Ŀ�ĵ���
ѡ�� | ʵ������ | ʵ��Ŀ�� |
A | ��5mL 0.005mol/L FeCl3��5mL 0.1mol/L KSCN�Ļ����Һ�У����뱥��FeCl3��Һ����Һ�ĺ�ɫ���� | ��֤Ũ�ȶԻ�ѧƽ���Ӱ�� |
B | �����£���pH��ֽ�ⶨŨ��Ϊ0.1mol��L-1 NaClO��Һ��0.1mol��L-1 CH3COONa��Һ��pH | �Ƚ�HClO��CH3COOH������ǿ�� |
C | �����£����Ũ�Ⱦ�Ϊ0.1mol/L��Һ��pH��NaA��NaB | ֤�������µ�Ka��HA��HB |
D | �������pH��Ϊ2��HA��HB������ֱ�������Zn��Ӧ��HA�ų���H2�� | ֤��HA��ǿ�� |
A. A B. B C. C D. D
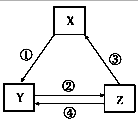
����Ŀ���±���������֮��ͨ��һ����Ӧ��ʵ����ͼ��ʾת����ϵ��������е�����Ҳƥ����ǣ� ��
ѡ�� | X | Y | Z | ��ͷ��Ϊ��Ӧ���� |
|
A | NO | NO2 | HNO3 | �ڼ�H2O | |
B | Al | NaAlO2 | AlCl3 | �۵�� | |
C | Fe | FeCl2 | FeCl3 | ��ͨ������Cl2 | |
D | NaOH | NaHCO3 | NaCl | ������ͨ��CO2��NH3 |
A.A
B.B
C.C
D.D